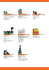3 - Katedra chemie FP TUL
Transkript
ACH 05
13. skupina – prvky s2p1
B, Al, Ga, In, Tl
I
II
III
IV
V
VI
VII
VIII
I
II
III
1
H
ns
2
Li
Be
3
Na Mg
4
K
Ca
Sc
Ti
5
Rb
Sr
Y
Zr Nb Mo Tc Ru Rh Pd Ag Cd
In
6
Cs
Ba Lu
Hf
Ta
Tl
7
Fr
Ra
Rf
Ha
IV
V
VI
VII
He
np
B
C
N
O
F
Ne
Al
Si
P
S
Cl
Ar
Cu Zn Ga Ge
As
Se
Br
Kr
Sn
Sb
Te
I
Xe
Pb
Bi
Po
At
Rn
(n-1) d
Lr
La
V
Cr Mn Fe
W
Re
Os
Co
Ir
Ni
Pt
VIII
Au Hg
Ce
Pr
Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb
Ac Th
Pa
U
Np Pu Am Cm Bk
Cf
Es Fm Md No
Katedra chemie FP TUL – www.kch.tul.cz
prvky
2
1
s p
polokov
Historie bóru
B
•borax užíván už
v starověku – emaily a tvrdá
borosilikátová skla
• jako prvek identifikován v 18. století
– Humprey Davy, Joseph Louis Gay-Lussac
• 1892 - izolace 95% boru - redukce B2O3 hořčíkem
• boron (Davy) – bor (ax + carb) on
Al
13. skupina – historie
Hans Christian Ørsted – reakce amalgamu K s AlCl3
Henri Etienne Sainte-Claire Deville redukce sodíkem
Robert Wilhelm Eberhard Bunsen elektrolýzou
roztaveného Na[AlCl4]
aluminium – Davy z latiny Alumen = kamenec
KAl(SO4)2·12H2O – staré Řecko a Řím
– užití v lékařství).
13. skupina – historie
Ga
• Mendělejev (1870) - eka-aluminium,
• P.E.Lecoq de Boisbaudran (1875) - spektroskopie,
Francie - Gallium.
13. skupina – historie
In
Ferdinand Reich, Hieronymus Teodor Richter (1863)
– ve zbytcích po zpracování sfaleritu – název podle
indigově modré spektrální čáry (latinsky Indicum)
Tl
13. skupina – historie
William Crookes (1861) – název podle zelené
spektrální čáry (řeckyThallos-ratolest)
B
Výskyt bóru
zemská kůra – relativně vzácný (~ 9 ppm –
srovnatený s Th, Pr)
– boritanové minerály – Kalifornie, Turecko, Rusko
– ~ 3.5 mil. tun / rok
B
Výskyt bóru
– ulexit – NaCa[B5O6(OH)6]·5H2O
– borax
– kernit – Na2[B4O6(OH)2]·3H2O
– kolemanit – Ca[B3O4(OH)3]·H2O
– sassolit – H3BO3
www.
mindat
.org
Al
13. skupina – výskyt
– 3. prvek zemské kůry
– nevyskytuje se jako volný prvek
– sloučeniny s kyslíkem:
–
–
–
–
–
–
korund Al2O3
hydrargillit Al(OH)3
bőhmit, bauxit, diaspor AlO(OH)
kaolinit Al4Si4O10·(OH)8
kryolit Na3[AlF6]
živce NaAlSiO4
www.mindat.org
Ga
13. skupina – výskyt
– doprovází Al, Ge, Zn
– gallit CuGaS2
– söhngeit Ga(OH)3
www.mindat.org
In
13. skupina – výskyt
– doprovází Zn
– indit – FeIn2S4
– dzhalindit – In(OH)3
www.mindat.org
Tl
13. skupina – výskyt
– v prachu při pražení pyritů,
v galenitu (PbS),
lorandit (TlAsS2), crookesit (Cu7TlSe4)
www.mindat.org
13. skupina – elektronegativita
2,5
2,04
2
2,04
2,01
1,78
1,61
1,5
1
0,5
0
B
Al
Ga
In
Tl
Postavení v elektrochemické řadě
-0,34
Tl
-0,34
In
-0,53
Al
-1,68
B
-0,89
-2
Ga
-1,5 V
-1
-0,5
0
Body tání [°C]
2500
2 180
2000
1500
1000
660
500
30
157
304
0
B
Al
Ga
In
Tl
Hustota [g.cm–3]
Tl
11,85
In
7,31
Ga
5,90
Al
2,70
B
2,34
0
5
10
15
Tepelná vodivost [W/m.K]
250
200
150
100
50
27
237
28
82
46
0
B
Al
Ga
In
Tl
B
Izolace prvku
redukce kovy za vysoké teploty
B2O3 + 3 Mg 2 B + 3 MgO
Moissanův bor (95-98%)
2 BCl3 + 3 Zn 2 B + 3 ZnCl2
B
Izolace prvku
elektrolýza boritanů nebo BF4–
v roztavené směsi KCl / KF (800°C)
B
Izolace prvku
redukce těkavých sloučenin vodíkem
2 BBr3 + 3 H2 B + 6 HBr
(katalyzátor Ta, čistota 99.9%)
B
Izolace prvku
tepelný rozklad boranů a halogenidů
B2H6 2 B + 3 H2
BI3 B + 3/2 I2 (800–1000°C, katalyzátor Ta)
Bayerův způsob zpracování bauxitu
Ruda se rozpustí v louhu sodném na hlinitan a z čistého
roztoku se zpět vysráží hydroxid hlinitý, který se vyžíhá
na oxid hlinitý
Al
http://cnx.org/content/m32149/latest/
Výroba hliníku
Al
Elektrolýza taveniny
oxid hlinitý + kryolit při 950 – 980 °C
Charles Martin Hall
Paul (Louis-Toussaint) Héroult
http://cnx.org/content/m32149/latest/
Další výrobní postupy pro Al
Al
1200°C
2 Al2O3 + 3 C + AlCl3 3 AlCl + 3 CO
600° C
3 AlCl 2 Al + AlCl3
13. skupina – výroba
Ga – elektrolýza roztoku Na[Ga(OH) ]
4
13. skupina – výroba
In
– In2(SO4)3 + 3 Zn 2 In + 3 ZnSO4
13. skupina – výroba
Tl
– elektrolýza roztoku Tl2SO4
2 TlCl + 2 KCN 2 Tl + 2 KCl + (CN)2
Tl2SO4 + Zn 2 Tl + 2 ZnSO4
B
Využití
Použití v průmyslu a domácnostech
• žáruvzdorná skla
• detergenty, mýdla, čistící prostředky,
kosmetika
• smalty, glazury
• syntetické herbicidy a hnojiva
• jaderná stínění, metalurgie, katalyzátory,
protikorozní ochrana
B
Využití
Chemické sloučeniny
• oxidy boru, kyselina boritá, boritany
• estery kyseliny borité
• žáruvzdorné sloučeniny (boridy)
• halogenidy
• borany, karborany, organoborany
13. skupina - využití
Al
–
–
–
–
Ga–
In
Tl
nádrže, nádoby
vodiče
aluminotermie
slitiny (dural)
slitiny
– polovodiče
– slitiny (ložiskové kovy)
– polovodiče
– slitiny (s Pb, Ag, Au)
B
Elementární bor
a-modifikace
tetragonální
B48C2, B48N2
b-modifikace – rhomboedrická,
105 atomů
http://www.vscht.cz/ach/ustav-osobni_sedmidub.html
B
Elementární bor
http://www.ccp14.ac.uk/ccp/web-mirrors/crystalimpact/diamond/gallery.htm
B
Jmol
Struktura prvků
Al
Ga
Tl
In
http://www.vscht.cz/ach/ustav
-osobni_sedmidub.html
Al
Ga
In
Tl
zobrazeno v Jmolu
www.webelements.com
Vazebné možnosti B
Elektronová konfigurace: [He] 2s2 2p1
– hybridizace sp2, sp3
– elektronová deficience – Lewisova kyselost
Elektronegativita: cP = 2.0
(H - 2.1, C - 2.5, Si - 1.8)
Ionizační energie: 800 kJ/mol
Atomový poloměr: 0,08 – 0,09 nm
Vazebné možnosti B
– vícestředové vazby
– absence jednovazných sloučenin
– obrovská strukturní bohatost
Koordinační vlastnosti:
ikosaedr B12
Vazebné možnosti B
– trojstředové vazby s vodíkem
Vazebné možnosti B
– trojstředové vazby mezi atomy bóru
Vazebné možnosti B
– trojstředové vazby mezi atomy bóru
Chemické vlastnosti B
inertní,
žáruvzdorný,
nekovový izolant,
vysoká tvrdost
– normální podmínky - nereaktivní:
B + F2 BF3 t
B + O2 B2O3 (pouze na povrchu)
– zvýšená teplota:
reakce se všemi nekovy
(kromě H, Ge, Te, vzácných plynů)
Chemické vlastnosti B
rozpouští se v H2SO4/HNO3 (koncentrované, 2:1)
B + 3 HNO3 H3BO3 + 3 NO2
odolává horkému koncentrovanému i roztavenému
NaOH
– vysoká teplota
reakce s kovy
rozpouští se v tavenině Na2CO3 / NaNO3 při 900°C
2 B + 6 NaOH 2 Na3BO3 + 3 H2 t > 500°C
Chemické vlastnosti hliníku
stříbrolesklý kov,
tažný,
kujný,
na vzduchu stálý (pasivace)
– 2 Al(s) + 3/2 O2(g) Al2O3(s) (hoření)
– Al(s) + C(s) Al4C3(s),
– Al(s) + N2(g) AlN(s),
– Al(s) + S(s) Al2S3(s)
Chemické vlastnosti hliníku
• amfoterní charakter
– Al + 3 HCl AlCl3 + 3/2 H2
– 2 Al + 2 NaOH + 6 H2O 2 Na[Al(OH)4] + 3 H2
– [Al(H2O)6]3+ [Al(OH)3(H2O)3] + 3 H+
– [Al(OH)3(H2O)3] Al(OH)3 + 3 H2O
– Al(OH)3 + OH– [Al(OH)4]–
– reakce probíhají rovnovážně i v opačném směru
Chemické vlastnosti Ga, In a Tl
lehce tavitelné kovy
na vzduchu –
Ga, In stálé
Tl + H2O + O2 TlOH
rozpouštějí se ve zředěných neoxidujících kyselinách
Chemické vlastnosti Ga, In a Tl
za vyšších teplot reagují s většinou nekovů
Soli – GaIII, InIII, Tll
2 Ga + 2 NaOH + 10 H2O 2Na[Ga(OH)4(H2O)2]
+ 3 H2
In se nerozpouští
TlI se chová podobně jako alkalické kovy
oxidy a hydroxidy GaI, InI, TlI jsou zasaditější než
GaIII, InIII, TlIII
Borany
Klasifikace:
closo–
uzavřené polyedry Bn
BnHn2nido–
klastry Bn z (n+1) polyedru
BnHn+4 (B2H6, B5H9, B6H10, B8H12, B10H14)
BnHn+3- (B5H8-, B10H13-)
BnHn+22- (B10H122-)
Borany
Klasifikace:
arachno– klastry Bn z (n+2) polyedru
BnHn+6 (B4H10, B5H11, B6H12, B8H14)
BnHn+5- (B2H7-, B3H8-, B5H10-)
BnHn+42- (B10H142-)
hypho–
klastry Bn z (n+3) polyedru
BnHn+8
conjuncto– spojení 2 a více předchozích typů
Borany
B2H6
B5H11
B6H10
B10H14
http://www.vscht.cz/ach/ustav-osobni_sedmidub.html
Chemie diboranu
Příprava a výroba:
diglym
2 NaBH4 + I2 B2H6 + 2 NaI + H2
diglym
3 NaBH4 + 4 Et2O.BF3 2 B2H6 + 3 NaBF4 + 4 Et2O
180°C
2 BF3 + 6 NaH 2 B2H6 + 6 NaF
diglym:
CH3O-CH2CH2-O-CH2CH2-OCH3
Chemie diboranu
Reaktivita:
samozápalný na vzduchu
B2H6 + 3 O2 B2O3 + 3 H2O
pyrolýza (t>100°C)
B2H6 {BH3} {B3H9} {B3H7}
B5H11
B4H10
Chemie diboranu
Reaktivita:
H
B
H
H
H
H
H
H
H
B
H
+L
B
B
H
H
H
H
H
L
L
H
B
+2L
H
B
L
H
H
B
H
H
H
Tetrahydridoboritany
Příprava a výroba:
2 LiH + B2H6 2 Li[BH4]
(dietyléter)
2 NaH + B2H6 2 Na[BH4] (diglym)
4 LiH + Et2O.BF3 Li[BH4] + 3 LiF + Et2O (Al2Et6)
BCl3 + 4 NaH Na[BH4] + 3 NaCl
Na2B4O7 + 7 SiO2 + 16 Na + 8 H2 Na[BH4] +
7 Na2SiO3
Tetrahydridoboritany
Reaktivita:
Redukční činidla:
selektivní redukce organických skupin –CHO, –CO
Na[BH4] + 8 NaOH + 9 SO2 4 Na2S2O4 + NaBO2 +
6 H2O
bezproudové niklování kovů a nekovových předmětů
NiCl2 + NaBH4 + NaOH + H2O (Ni3B+Ni) +
NaB(OH)4 + NaCl + H2
Boridy
Příprava:
koredukce halogenidů H2
TiCl4 + BCl3 + H2 TiB2 + HCl
elektrolytické vylučování z roztavených solí
MOn + B2O3 (Na2B4O7) + roztavená sůl
700-1000°C, C-katoda
redukce BCl3 kovem
BCl3 + W WB + Cl2 + HCl
Boridy
Použití:
MoB
– tvrdost,
– chemická inertnost
– netěkavost
– žáruvzdornost
– konstrukční materiály
ZrB
– povrchy turbín, spalovacích komor,
raketových trysek, rotorů čerpadel
reakční nádoby, elektrody
CoB
Boridy
Klasifikace:
Izolované atomy B (Mn4B, M3B, M2B)
Izolované dimery B2 (Cr5B3, M3B2)
Pilovité řetězce (M3B4, MB)
MB12
MB6
CaB6
ZrB12
http://www.vscht.cz/ach/ustav-osobni_sedmidub.html
Boridy
Klasifikace:
Rozvětvené řetězce (Ru11B8)
Dvojité řetězce (M3B4)
2D – sítě (MB2)
TiB2
Cr3B4
http://www.vscht.cz/ach/ustav-osobni_sedmidub.html
Boridy
Příprava:
přímé slučování
Cr + nB CrBn
redukce oxidu borem, B4C
Sc2O3 + B ScB2 + B2O3
Eu2O3 + B4C EuB6 + CO
koredukce oxidů uhlíkem
V2O5 + B2O3 + C VB + CO
AlH3
Hydridy
krystalická látka obsahující oktaedry AlH6,
můstkové H
Et2O
Li[AlH4] + AlCl3 [AlH3(Et2O)n] + LiCl
M[AlH4]
Hydridy
– bílá krystalická látka
4 LiH + AlCl3 Li[AlH4] + 3 LiCl Et2O
Na + Al + 2 H2 Na[AlH4]
140°C, 34 MPa
– snadno podléhá hydrolýze
Li[AlH4] + H2O Li[Al(OH)4] + H2
– hydrogenační činidlo v organické syntéze
Hydridy
GaH3, InH3 – nestálé
BF3
Halogenidy boru
(Tv = –100°C)
Příprava:
Na2B4O7 + 6 CaF2 + 8 H2SO4 4 BF3 + 2 NaHSO4
+ 6 CaSO4
Na2B4O7 +12 HF+2 H2SO4 4 BF3 + 2 NaHSO4 +
H2O
BF3
Halogenidy boru
Vlastnosti:
deficit elektronů na B – Lewisova kyselina
adukty BX3 – Lewisova báze
BF3 + NH3 BF3·NH3
BX3 + 3 H2O H3BO3 + 3 HX
4 BF3 + 6 H2O 3 H3O+ + 3 [BF4]– + H3BO3
Halogenidy boru
BCl3 – BBr3
(Tv= 12°C – 91°C)
Příprava:
B2O3 + 3 C + 3 Cl2 (Br2) 2 BCl3 (BBr3) + 3CO
– redukční halogenace
BF3 + BCl3 BClF2 + BCl2F
Halogenidy boru
BCl3 – BBr3
(Tv= 12°C , 91°C)
Příprava:
B2O3 + 3 C + 3 Cl2 (Br2) 2 BCl3 (BBr3) + 3 CO
– redukční halogenace
Vlastnosti:
deficit elektronů na B – Lewisovy kyseliny
BX3 + 3H2O H3BO3 + 3 HX
BI3
Halogenidy boru
(Tt = 50°C)
Příprava: I2 + LiBH4 BI3 + LiI + H2
Halogenidy Al
AlF3
– krystalická látka, netěkavá,
nerozpustná
700°C
Al2O3 + 6 HF 2 AlF3 + 3 H2O
AlF3 + 3 F– [AlF6]3–
Na3[AlF6]
– krystalická látka
Al2O3 + 3 Na2CO3 + 12 HF 2 Na3[AlF6] + 3 CO2
+ 6 H2 O
– použití: metalurgie hliníku, sklářství, výroba
smaltů
Halogenidy Al
AlCl3, AlBr3, AlI3
přímé slučování Al s halogenem
(halogenvodíkem)
700°C
Al2O3 + 3 C + 3 X2 AlX3 + 3 CO
– dimery Al2X6 (tetraedrická koordinace Al),
AlCl3 – oktaedry
– Lewisovy kyseliny
– Friedel-Craftsova katalýza
Halogenidy
GaF3, InF3, TlF3
– krystalické látky, netěkavé, vysoké Tt
(NH4)3 [MF6] MF3 + 3 NH3 + 3 HF
Tl2O3 + F2 (BrF3, SF4) TlF3
300°C
Halogenidy
chloridy, bromidy, jodidy MX3
– těkavé,
– Lewisovy kyseliny
– tvorba aduktů MX3L, MX3L2, ..
Halogenidy
nižší halogenidy Ga, In, Tl
300°C
2 Ga + GaX3 3 GaX
In + X2 (Hg2X2) InX (+ Hg)
Tl+ + X- TlX
(struktura CsCl)
B2O3
H3BO3
Boritany
(BO3)3-
(BO4)5-
[B(OH)4]-
(B2O5)4-
[B2O(OH)6]2-
(B3O6)3-
[B2(O2)2(OH)4]2-
[B4O5(OH)4]2[B3O3(OH)5]2[B5O6(OH)4]-
Oxidy a hydroxidy Al
a-Al2O3
– korund,
hexagonální uspořádání O2–,
Al ve 2/3 oktaedrických poloh
g-Al2O3
– krychlové uspořádání O2– (odvozený
od spinelu)
– dehydratace gibbsitu (böhmitu)
T < 450°C
Oxidy a hydroxidy Al
a-AlO(OH)
– diaspor
– hexagonální uspořádání O2–, OH–
g-AlO(OH)
– böhmit
– krychlové uspořádání O2–, OH–
a-Al(OH)3
– bayerit
g-Al(OH)3
– gibbsit (hydrargillit)
Oxidy a hydroxidy Al
korund
diaspor
gibbsit
böhmit
http://www.vscht.cz/ach/ustav-osobni_sedmidub.html
Oxidy a hydroxidy Al
korund
gibbsit
diaspor
böhmit
Oxidy a hydroxidy Al
korund
gibbsit
diaspor
böhmit
Oxidy a hydroxidy Ga
a, g – Ga2O3, Ga(OH)3
– analogické Al2O3 a Al(OH)3
b–Ga2O3
– nejstabilnější, krychlové uspořádání O2–
Oxidy a hydroxidy In
In2O3
InO(OH)
– rutilová struktura
In(OH)3 InO(OH) + H2O
In(OH)3
InCl3 + 3 NH3 + 3 H2O In(OH)3 + 3 NH4Cl
Oxidy a hydroxidy Tl
Tl2O
Tl2CO3 Tl2O + CO2
hygroskopický TlOH
Tl2O3
Tl+ + Cl2 (Br2) Tl3+ + 2 Cl– (Br–)
Tl2O3.3/2H2O
Karbid boru
Výroba:
B2O3 + C B4C + CO 1600°C
Použití:
Neutronové štíty, kontrolní
tyče v jaderných reaktorech
brusivo,
leštící přípravky, obložení
brzd
lehké štíty, pancíře
B 4C
Nitrid boritý
kubický
BN
Výroba:
BN (hexagonální) BN (kubický) (1800°C, tlak 8,5 TPa)
extrémní tvrdost
Nitrid boritý
hexagonální
BN
Příprava a výroba:
Na2B4O7 + NH4Cl BN + NaCl + H2O (900°C, NH3)
H3BO3 + CO(NH2)2 BN + CO2 + H2O (750°C)
BCl3 + NH3 BN + HCl
elektrický izolant,
výborný tepelný vodič
Karborany
Příprava:
B10H14 + 2 Et2S B10H12(Et2S)2 + H2
B10H12(Et2S)2 + C2H2 C2B10H12 + 2 Et2S + H2
1,2–C2B10H14
2,3–C2B4H8
Polovodiče AIIIBV
Zakázaný pás kJ/mol
Bod tání ºC
Souhrn chemických vlastností
Oxidační stavy
+
– základní III
,
– mohou být i nižší
+
– thalium má stabilní oxidační stav I
,
+
– thalium III
má silné oxidační vlastnosti
Souhrn chemických vlastností
Hydrolýza
– většina solí hydrolyzuje – dáno slabými
hydroxidy,
– kation boritý prakticky neexistuje
– boritany hydrolyzují (soli slabých kyselin)
– thalné soli téměř nehydrolyzují,
– thalité silně hydrolyzují
Souhrn chemických vlastností
Barevnost sloučenin je dána anionty,
binární sloučeniny mohou být zbarveny
Souhrn chemických vlastností
Rozpustnost ve vodě
– většina hlinitých solí je ve vodě rozpustných,
ale hydrolyzují na nerozpustné hydroxo-soli
až hydroxid hlinitý
Nerozpustný je fosforečnan AlPO4
Souhrn chemických vlastností
B je důležitý stopový prvek pro rostliny
Al ionty škodí zdraví
– napomáhá rozvoji Alzheimerovy choroby
Ga
neprokázaný vliv na lidský organizmus
Souhrn chemických vlastností
In nepatrná množství mají stimulativní vliv
na metabolizmus
Tl
všechny soli thalia jsou jedovaté
– poškozují nervový systém
– účinek je kumulativní
– předpokládá se prostup kůží
– prokázána teratogenita
!
Příští přednáška
14. skupina periodické soustavy
Prvky s2p2
Podobné dokumenty
Přirozená rezistence bakterií rodu Streptomyces - Česko
 z rodu Fusarium ohrožují kvalitu ječmene.
z rodu Fusarium ohrožují kvalitu ječmene.
3. Chemie organická a názvosloví
 26. Kyselinu pyrohroznovou lze získat :
a) oxidací kyseliny mléčné
b) redukcí kyseliny vinné
c) oxidací kyseliny octové
d) oxidací kyseliny jablečné
27. Kyselina acetooctová se může snadno na vzduc...
26. Kyselinu pyrohroznovou lze získat :
a) oxidací kyseliny mléčné
b) redukcí kyseliny vinné
c) oxidací kyseliny octové
d) oxidací kyseliny jablečné
27. Kyselina acetooctová se může snadno na vzduc...
obor Anorganická chemie
 Alkalické kovy a jejich sloučeniny, organolithné sloučeniny. Iontové sloučeniny a jejich základní
strukturní typy. Berylium, hořčík a kovy alkalických zemin. Rozpustnost anorganických sloučenin.
Gr...
Alkalické kovy a jejich sloučeniny, organolithné sloučeniny. Iontové sloučeniny a jejich základní
strukturní typy. Berylium, hořčík a kovy alkalických zemin. Rozpustnost anorganických sloučenin.
Gr...
2. Anorganická chemie
 Iontové hydridy, zejména hydrid sodný, se využívají jako silné báze v organické
syntéze a jejich vysoké reaktivity vůči vodě se využívá k sušení některých organických
rozpouštědel. Vyrábějí se přím...
Iontové hydridy, zejména hydrid sodný, se využívají jako silné báze v organické
syntéze a jejich vysoké reaktivity vůči vodě se využívá k sušení některých organických
rozpouštědel. Vyrábějí se přím...
Technical Centre
 Team Leader Development
P. Herkommer
Development Engineer
P. Polodna
M. Haufer
M. Francová
R. Holubec
Technician
J. Šantavý
L. Kubáček
Mechanic
M. Černý
P. Jonáš
J. Vyčítal
M. Hrabálek
M. Vavruška
...
Team Leader Development
P. Herkommer
Development Engineer
P. Polodna
M. Haufer
M. Francová
R. Holubec
Technician
J. Šantavý
L. Kubáček
Mechanic
M. Černý
P. Jonáš
J. Vyčítal
M. Hrabálek
M. Vavruška
...

 II. skupina periodické soustavy
II. skupina periodické soustavy
 tetragonální
2,32 g cm-3
tetragonální
2,32 g cm-3