Biochemie 1 aminokyseliny
Transkript
Biochemie 1 aminokyseliny
AMINOKYSELINY Obsah • • • • • • • • Obecná struktura Názvosloví, třídění a charakterizace Nestandardní aminokyseliny Reaktivita - peptidová vazba Biogenní aminy Funkce aminokyselin Acidobazické vlastnosti Optická aktivita Aminokyseliny Obecná struktura a-aminokyselin • a-aminokyseliny (2-aminokyseliny) • R – specifický zbytek jednotlivých AK • Ve fyziologickém prostředí ve formě amfiontu Definice amfionty: obsahují jak kyselé, tak basické skupiny. V neutrálním roztoku karboxylová skupina ztrácí proton a vzniká z ní záporně nabitá skupina -COO-, aminoskupina zde proton přijímá a vzniká kladně nabitá skupina -NH3+. Volný náboj aminokyseliny, obsahující jednu karboxylovou a jednu aminovou skupinu, je tedy v neutrálním roztoku nulový. Pro každý amfion existuje určitá hodnota pH, při níž má nulový volný náboj (tzv. isoelektrický bod). Třídění aminokyselin • V bílkovinách 20 + 2 (proteinogenní) • Posttranslační modifikace • Volné AK a deriváty, složky jiných biomolekul • Dělení podle struktury – významných vlastností • Nepolární – neutrální – alifatické • Polární nedisociované (zbytky R) • Polární disociované (zbytky R) • Kyselé • Bazické • Jiné dělení • • • Aromatické Sirné Heterocyklické apod. Nepolární - alifatické Glycin • Nejmenší AK • První objevená AK, v hydrolyzátu želatiny v roce 1820 Nepolární - alifatické, větvené, sirné Nepolární - aromatické Tryptofan • Indolová skupina Fenylalanin • Fenolová skupina Tyrozin • Je řazený i mezi polární nedisociované AK Nepolární heterocyklické Prolin • Cyklická a-iminokyselina • Pyrrolidinová postranní skupina • Vliv na strukturu polymeru – bílkoviny Polární - nedisociované Tyrozin, serin, threonin • Hydroxy AK Polární - nedisociované Cystein • Thiolová skupina • Sirná - (slabě kyselá) • Možnost tvorby disulfidové můstky (vznik cystinu) Asparagin, glutamin • Amid kys. asparagové, resp. glutamové H C O C CH2 + SH Cystein NH SH CH2 C O C Cystein NH H 1/2 O2 H2O H C O C CH2 NH S S NH disulfidová vazba CH2 C O C H Polární - disociované - bazické Lysin • Butylamoniový postranní řetězec Arginin • Guanidinová skupina Histidin • Imidazolová skupina • Při pH 6 postranní skupina disociována z 50 % • V zásaditém prostředí – neutrální molekula Polární - disociované - kyselé Aspartát, glutamát • Při pH vyšším než 3 negativní náboj Speciální aminokyseliny Selenocytein "21. proteinotvorná aminokyselina" • Je zvláštní neesenciální proteinogenní aminokyselina podobná cysteinu, místo atomu síry atom selenu. -SeH (pKa-5,3) má nížší pKa než –SH (pak-8,3), je převážně v disociovaném stavu v buňce • Hlavní zdroj organického selenu (stopový prvek) • U člověka obsažena v cca 10 bílkovinách • Selenocystein se váže na speciální tRNA, která nese antikodon UCA. Tento antikodon rozeznává UGA kodon na mRNA, což je za normálních okolností stopkodon - žádná aminokyselina by se v tomto případě neměla zařadit a prodlužování proteinu by se mělo zastavit. • Zařazení selenocysteinu, je způsobeno sekvencí v bezprostředním okolí kodonu UGA Selenocystein v proteinech s enzymovou aktivitou Enzym Funkce glutathionperoxidasa odbourání hydroperoxidů v lipidech (R-O-H) dejodasa přeměna tyroxinu na trijodtyronin thioredoxinreduktasa antioxidační ochrana, syntéza deoxyribonukleotidů Speciální aminokyseliny Pyrolyzin "22. proteinotvorná aminokyselina" • Zvláštní proteinogenní aminokyselina • Začleňování pyrolysinu jako proteinogenní aminokyseliny bylo objeveno u některých archebakterií (Methanosarcina barkeri) v enzymu monomethylaminmethyltransferasa • U prokaryot, jako jsou archebakterie Methanococcoides burtoni či grampozitivní bakterie Desulfitobacterium hafniense • Bakterie Desulfitobacterium hafniense je zatím jediný známý organismus, který používá při translaci všech 22 aminokyselin Proteinogenní aminokyseliny Proteinogenní aminokyseliny Proteinogenní aminokyseliny Názvy a zkratky • Troj- a jednopísmenkové AMK glycin alanin valin leucin izoleucin serin threonin cystein histidin prolin selenocystein Symboly Gly Ala Val Leu Ile Ser Thr Cys His Pro Sec G A V L I S T C H P U AMK methionin glutamová k. asparagin glutamin lysin arginin tyrosin fenylalanin tryptofan asparagová k. pyrolyzin Symboly Met Glu Asn Gln Lys Arg Tyr Phe Trp Asp Pyl M E N Q K R Y F W D O Základy biochemie ZS 2014 Esenciální aminokyseliny nezbytná složka potravy, neumíme je syntetizovat • • • • rozvětvené (Val, Leu, Ile) aromatické (Phe, Trp) bazické (Lys, Arg, His) Thr, Met Modifikované aminokyseliny Nestandardní aminokyseliny • Mohou být složkou proteinů nebo biologicky aktivních polypeptidů • Vznik – modifikací aminokyselinových zbytků v již syntetizovaném polypeptidickém řetězci Kolagen • 4-hydroxyprolin, 5-hydroxyprolin Histony • AK mohou být methylovány, acetylovány, fosforylovány, sulfurylovány Proteiny působící při srážení krve • g-karboxyglutamová kys Volné aminokyseliny a deriváty Součásti jiných biomolekul • b-alanin Meziprodukty metabolických drah • • homocystein, S-adenosylmethionin ornitin a citrulin Nervové mediátory a hormony • • • glycin, g aminomáselná (GABA) DOPA, dopamin, adrenalin thyroxin, trijodthyronin Antibiotika • azaserin, cykloserin, chloramfenikol Volné aminokyseliny a deriváty Biogenní aminy Aminokyselina Amin Funkce Serin etanolamin součást lipidů Cystein cysteamin součást koenzymu A Treonin aminopropanol součást vitamínu B12 Aspartát b-alanin součást koenzymu A Ornitin putrescin základní polyamin Glutamát g-aminobutyrát neurotransmiter (GABA) Histidin histamin mediátor, neurotransmiter Dopa dopamin neurotransmiter 5-hydroxytryptofan serotonin mediátor, neurotransmiter Arginin agmatin neuromodulátor • Vznik – dekarboxylací AK • Inaktivace – deaminací a současnou oxidací na aldehyd – aminoxidasy (inhibitory aminoxidas – významné účinky na metabolismus neurotransmiterů) Funkce aminokyselin Funkce Příklad Stavební součást peptidů a bílkovin 20+2 proteinogenních AK Stavební součást fosfolipidů serin ve fosfolipidech glycin ve žlučových kyselinách Stavební součást glycin ve žlučových kyselinách Neurotansmitery nebo jejich prekurzory glutamát, aspartát, glycin Prekurzory oxokyselin, biogenních aminů, glukózy, nukleotidů, hemu, kreatinu, hormonů, neurotransmiterů… Transportní molekula (-NH2) pro skupinu (-NH2) Acidobazické vlastnosti • Obojetné ionty x zjednodušené vzorce • Rozpustnost ve vodě, téměř nerozpustné v organických rozpouštědlech Hodnoty pK ionozovatelných skupin dvaceti základních a-aminokyselin při 25°C a-aminokyselina pK1 (a-COOH) pK2 (a-NH3+) Alanin 2,35 9,87 Arginin 1,82 8,99 Asparagin 2,10 8,84 Asparagová kyselina 1,99 9,90 3,90 (b-COOH) Cystein 1,92 10,78 8,33 (thiol) Fenylalanin 2,16 9,18 Glutain 2,17 9,13 Glutamová kyselina 2,10 9,47 Glycin 2,35 9,78 Histidin 1,80 9,33 Isoleucin 2,32 9,76 Leucin 2,33 9,74 Lysin 2,16 9,18 Methionin 2,13 9,28 Prolin 2,95 10,65 Serin 2,19 9,21 Threonin 2,09 9,10 Tryptofan 2,43 9,44 Tyrosin 2,20 9,11 Valin 2,29 9,74 pKR (postranní řetězec) 12,48 (guanidinium) 4,07 (b-COOH) 6,04 (imidazolium) 10,79 (e-NH3-) 10,13 (fenol) Titrační (disociační) křivka glycínu • Disociace AK • Jednoduchá struktura • Více disociabilních skupin – složitější křivka • Pojem pI (izoelektrický bod = hodnota pH, kdy má molekula nulový elektrický náboj) pKCOOH + pKNH2 pI = 2 Titrační (disociační) křivka histidinu Aromatické aminokyseliny absorbují světlo v UV oblasti: HO HC HC C CH CH CH CH HC CH C + C CH C CH C CH2 - COO H3N + CH CH C HN CH C CH2 H3N CH C CH2 - COO H3N + C - COO H H H Fenylalanin (Phe, F) Tyrosin (Tyr, Y) Tryptofan (Trp, W) Absorpční spektra a molární absorpční koeficienty Trp, Phe a Tyr: 40 000 20 000 10 000 5 000 Trp 2 000 e 1 000 Tyr 500 200 100 Phe 50 20 10 200 220 240 260 280 300 320 (nm) Tyr a Trp silně absorbují v oblasti 250 – 300 nm → možnost fotometrického stanovení Chemická reaktivita Reakce karboxylu • Tvorba solí (disociace – viz výše) • Tvorba esterů • Tvorba anhydridů • Tvorba amidů – vazba –CO-NHReakce aminoskupin • Tvorba solí (disociace – viz výše) • Acylace – vazba –CO-NH• Diazotace – R-CH(NH2).COOH + HNO2 = R-CH(OH).COOH + N2 – van Slyke Reakce skupin bočního řetězce • Speciální, podle druhu AK • Význam metabolický – struktura, funkce (oxidace –SH aj.) • Analytické využití Vazba jiných sloučenin na protein • Ser, Thr, (Tyr) ← vazba fosfátu nebo sacharidu • Asn ← vazba sacharidu Tvorba disulfidových můstků (oxidace/redukce): • 2 Cys-SH → Cys-S-S-Cys („cystin“) Významné reakce aminokyselin • tvorba solí • dekarboxylace → biogenní aminy • transaminace → 2-oxokyseliny • oxidativní deaminace → 2-oxokyseliny • tvorba peptidové vazby → peptidy a proteiny Peptidová vazba • kovalentní chemická vazba • obsahuje seskupení atomů –CO–NH– • typická např. pro proteiny a polypeptidy • vzniká kondenzací jednotlivých aminokyselin • kondenzace hydroxylové a primární aminové skupiny Optická aktivita chiralita aminokyselin • Všechny proteinogenní AK (s vyjímkou glycinu) jsou opticky aktivní – stáčí rovinu polarizovaného světla – L isomer • Centrum chirality – a-atomy C aminokyselin Fischerovy projekční vzorce • • • L-aminokyseliny typické pro většinu biomolekul D-aminokyseliny – vzácně Nejméně 1 asymetrický C (vyjímka Gly) CAHN-INGOLD-PRELOGŮV model absolutní konfigurace • Substituenty na a-uhlíku se řadí podle klesající priority. • Substituenty s vyšším atomovým číslem zařazeny před ty s nižším. • Směr šipky proti směru hodinových ručiček značí S konfiguraci (sinister = doleva) Skupiny dle klesající priority SH; OR; OH; NH-COCH3; NH2; COOR; COOH; CHO; CH2OH; C6 H5; CH3; 3H; 2H; H Absolutní konfigurace • Gly (G) není chirální • L-Cys (C) je v absolutní konfiguraci R • Ile (I) a Thr (T) mají dvě chirální centra • L-Ile (2S,3S), L-Thr (2S,3R) L-konfigurace – čtení ve směru hodinových ručiček CORN Všechny ostatní L-aminokyseliny mají S konfiguraci !!! Optická otáčivost aminokyselin • Důsledkem chirality aminokyselin je vlastnost jejich roztoků otáčet rovinu polarizovaného světla (kmitá v jedné rovině). • Otočení • ve směru hodinových ručiček: Značíme (d nebo +), • proti směru hodinových ručiček: Značíme (l nebo -) • Nezaměňovat l a L , d a D !!! Některé L-aminokyseliny otáčí doprava (např. L-Leu) !!! Měří se polarimetrem. • Úhel otočení závisí na: • délce optické dráhy (1 dm), • vlnové délce polarizovaného 589,3 nm), • koncentraci roztoku a teplotě. světla (žlutá D čára sodíku Polarimetr
Podobné dokumenty
Otázky pro písemnou část zkoušky z předmětu Strukturní
 maximální prostorová vzdálenost atomů abychom v jejich NMR spektrech mohli pozorovat NOE?
17. V čem spočívá měření 2D NMR spekter?
18. Jaké jsou výhody NMR spektroskopie oproti rentgenové krystalog...
maximální prostorová vzdálenost atomů abychom v jejich NMR spektrech mohli pozorovat NOE?
17. V čem spočívá měření 2D NMR spekter?
18. Jaké jsou výhody NMR spektroskopie oproti rentgenové krystalog...
Čtvrtá - Gymnázium Havlíčkův Brod
 - emoční přestřelení: amygdala a paměť
- čelní laloky, pracovní paměť a IQ
- sebeuvědomění, jazykové oblasti neokortexu a síla symbolů
- negativní emoce a jejich ovládání
- síla pozitivních emocí
-...
- emoční přestřelení: amygdala a paměť
- čelní laloky, pracovní paměť a IQ
- sebeuvědomění, jazykové oblasti neokortexu a síla symbolů
- negativní emoce a jejich ovládání
- síla pozitivních emocí
-...
 TEORIE A ZADÁNÍ ÚLOH
TEORIE A ZADÁNÍ ÚLOH
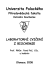 α−Aminokyselina
α−Aminokyselina