Koroze - Talnet
Transkript
Koroze Úvod Jako téma své seminární práce v T-kurzu jsem si zvolil korozi, zejména korozi železa a oceli. Větší část práce jsem zpracoval experimentálně, abych zjistil podmínky urychlující nebo naopak zpomalující rezivění. Tato otázka je velice důležitá i z praktického hlediska, protože znalost a možnost předpovědi chování železných a ocelových součástek je v průmyslu velmi cenná. Pokud totiž například není ocelová konstrukce dostatečně zabezpečena proti účinkům koroze a korozivního prostředí, může se oslabit a v důsledku způsobit nemalé škody na majetku, nebo dokonce na zdraví lidí. Proto je nutné tyto konstrukce a součástky chránit. Vždyť ztráty způsobené korozí jsou obrovské: jen v České republice se odhadují na zhruba 3,5% HDP, což je cca 50 mld. Korun. Koroze obecně Koroze obecně Ačkoli většinu lidí při vyslovení slova KOROZE napadne okamžitě rezivění železa a železných konstrukcí, není to úplně přesné. Ve skutečnosti se koroze týká v podstatě všech kovů (až na výjimky typu Au, Pt). Přesto zůstává koroze železa nejdůležitější a proto se jí budu nadále věnovat. Koroze se obvykle rozlišuje na korozi neželezných kovů a železa (a ocelí, aj.). Koroze se také většinou dělí podle principu na korozi chemickou a elektrochemickou, jejichž princip je dosti rozdílný, proto je popíšu odděleně. Koroze chemická Koroze chemická, jak už sám název napovídá, není spojena s průběhem žádných elektrických proudů na rozdíl od koroze elektrochemické. Tato koroze nevyžaduje elektrolyt a proto probíhá zejména v suchých plynech (hlavně za vyšších teplot) a silných kyselinách. Příkladem může být například koroze železa v kyselině chlorovodíkové: Fe + 2HCl → FeCl2 + H2 Tato koroze samozřejmě probíhá i v jiných prostředích – třeba ve vodě nebo na vzduchu. Zde se ale obvykle kombinuje s korozí elektrochemickou. Také rychlost je v různých kombinacích odlišná – zlato nebo platina téměř nekorodují na rozdíl od alkalických kovů, které jsou na vzduchu velmi rychle oxidovány. Zajímavá je také tzv. pasivace některých kovů (měď, hliník, chrom, železo v koncentrované H2SO4), kdy se kov pokryje souvislou neprodyšnou vrstvičkou oxidu (nebo jiné stabilní sloučeniny) a tato vrstva působí jako izolace před korozivním prostředím. Koroze elektrochemická Koroze elektrochemická, jak už název napovídá, probíhá pouze při průchodu elektrického proudu. Je tedy zapotřebí elektrolytu a elektrod. Tato koroze probíhá dvěma na sobě závislými reakcemi – katodovou a anodovou. Nemohou existovat nezávisle na sobě, přestože katoda od anody může být dosti vzdálena. Pokud na kov působí elektrolyt, kationty kovu přechází do roztoku a kov se nabíjí záporně. Aby mohla koroze dále pokračovat, musí se kov vybíjet – buď s kationty roztoku nebo, s přístupem kyslíku, reakcí s kyslíkem. Tyto dvě reakce – přechod iontů do roztoku a vybíjení náboje neprobíhá na jednom místě. Vždy existují tzv. anodová a katodová místa. Ta se tvoří na místech odlišných buď chemicky nebo fyzikálně (hrany,...). Oba tyto typy odlišností se uplatňují při korozi železa, to totiž nikdy není chemicky čisté, ale vždy obsahuje příměsi – především uhlík nebo jiné kovy jako legury. Koroze atmosférická Někdy se ještě rozlišuje koroze elektrochemická probíhající v malé vrstvičce nebo kapce vody na povrchu kovu. V takových podmínkách se vodní vrstva chová jinak než „obyčejná“ kapalná voda v silné vrstvě, protože se výrazněji uplatňují síly povrchového napětí. Korozi tedy podstatně urychluje vysoká vlhkost vzduchu a jeho znečištění. Koroze železa Chemickými reakcemi popíšu korozi železa v kontaktu s vodou – elektrolytem. Vzniká elektrochemický článek, poločlánkové reakce jsou uvedeny dále. Nejprve přejdou do roztoku ionty železa Fe2+ : Fe → Fe2+ + 2ePoté se vybijí přebytečné elektrony tzv. depolarizací kyslíkem: 2e- + H2O + ½ O2 → 2 OHTyto ionty poté reagují s kationty železnatými v roztoku: Fe2+ + 2 OH- → Fe(OH)2 Hydroxid železnatý dále reaguje s kyslíkem a přechází na stabilnější hydroxid železitý. Mimoto vzniká mnoho „podivných“ sloučenin, jako hydroxid-oxid, hydratovaný oxid, oxid, …, jejichž směs označujeme jako „rez“. 2 Fe(OH)2 + H2O + ½ O2 → 2 Fe(OH)3 V silně kyselém prostředí může depolarizace probíhat i vodíkem: 2e- + 2 H+ → H2 Pokud je kterýkoli z těchto dějů přerušen nebo zastaven, koroze přestává probíhat. Experimentální část Rozhodl jsem se provést experiment, který měl ukázat, jak souvisí koroze železa s prostředím, v němž probíhá. V osmi zkumavkách jsem připravil 5 různých prostředí – postupně od čisté vody, přes suchý vzduch, vodu bez přístupu vzduchu, kyselé prostředí až po slanou vodu – a 3 různé povrchové úpravy železa – tukový nátěr, styk s ušlechtilejším kovem (mědí) a styk s méně ušlechtilým kovem (hliníkem). Pak jsem do každé zkumavky vložil jeden očištěný a odmaštěný hřebík. Poté jsem všechny zkumavky postavil do stojanu a nechal hřebíky korodovat. Během celého pokusu jsem pořídil celkem tři série fotografií. První hned při zahájení, kdy byly hřebíky čisté. Druhou sérii jsem vyfotografoval zhruba v polovině experimentu. Poslední třetí série byla pořízena na konci pokusu – cca po 1 měsíci. Provedení experimentu 1.zkumavka byla kontrolní – naplněná destilovanou vodou a s otevřeným hrdlem. 0. den 11. den 28. den 2. zkumavka byla bez roztoku a zazátkovaná – hřebík korodoval pouze vlivem nepříliš vlhkého vzduchu. 0. den 11. den 28. den 3. zkumavka byla naplněna vodou a neprodyšně uzavřena zátkou a vrstvou oleje na hladině – koroze probíhala v podstatě bez přístupu kyslíku. 0. den 11. den 28. den 4. zkumavka obsahovala slabý roztok H2SO4 – takové podmínky panují v oblastech, kde jsou v ovzduší oxidy síry – zplodiny po spalování nekvalitního uhlí, případně v oblastech, kde padají kyselé deště. 0. den 11. den 28. den 5. zkumavka s roztokem NaCl měla dokumentovat vliv slané „mořské“ vody na rychlost koroze. 0. den 11. den 28. den V 6. zkumavce byla sice čistá voda, ale hřebík byl chráněn vrstvou bílé vazelíny, tedy tuku. 0. den 11. den 28. den Do 7. zkumavky byl ponořen hřebík omotaný měděným drátem pro zdokumentování koroze v přítomnosti ušlechtilejšího kovu – v praxi se toto stává například při špatném zvolení materiálů a jejich styku. 0. den 11. den 28. den V 8. zkumavce korodoval hřebík omotaný hliníkovou fólií – styk s méně ušlechtilým kovem. 0. den 11. den 28. den Vyhodnocení experimentu První zkumavka byla kontrolní – s tou budu porovnávat všechny ostatní. V této zkumavce hřebík zkorodoval, přičemž většina rzi se uvolnila do roztoku a usadila se na dně, část rzi se ovšem volně vznáší v roztoku. V 2. zkumavce nebyl žádný roztok, pouze vzduch, není tedy překvapivé, že hřebík skoro vůbec nezkorodoval. Třetí zkumavka sice byla pod zátkou a vrstvou oleje, přesto hřebík zkorodoval srovnatelně jako v první. Částečky rzi opadané do vody jsou ale poněkud světlejší. Sice se dalo počítat s korozí vlivem kyslíku rozpuštěného ve vodě, ale ten se měl brzy vyčerpat. Ve čtvrté zkumavce naplněné mírně kyselým roztokem hřebík podle očekávání zrezivěl nejvíc ze všech zkoumaných prostředí. I zde ale mají částečky rzi světlejší barvu než u kontrolního vzorku. Největším překvapením celého experimentu byla pátá zkumavka, ve které, přes její salinitu, hřebík zkorodoval jen minimálně. Tento stav nedokážu vysvětlit. Hřebík v šesté zkumavce byl chráněn vrstvou tuku, která ho chránila před přístupem vody a tedy před korozí. Hřebík ze sedmé zkumavky omotaný mědí zkorodoval srovnatelně s kontrolním vzorkem, zatímco měď nejeví sebemenší známky poškození. Ani to ale není výsledek přesně podle mého očekávání, železo mělo zkorodovat mnohem více. V osmé zkumavce jsou sice vidět částečky rzi, ale i hliníková fólie korodovala. Přitom koroze železa by probíhat vůbec neměla, protože hliník je méně ušlechtilý a tedy reaktivnější kov. Závěr Korozi nejvíce urychluje kyselé prostředí, což není žádným překvapením, dále styk s mědí jako ušlechtilým kovem. Naopak nejpomalejší bylo rezivění ve vzduchu a pod vrstvou tuku, což byl také očekávaný výsledek, ale relativně málo korodovala ocel i v slaném prostředí. Největšími překvapeními jsou rychlá koroze bez přístupu vzduchu a relativně pomalé rezivění v roztoku NaCl. Literatura Chemie kolem nás, Zdeněk Opava, Albatros 1986 Přehled středoškolské chemie, SPN 1993 Praktická a laboratorní výuka chemie, Olga Mokrejšová, Triton 2005
Podobné dokumenty
starověké orientální despocie
 postavy – hlava, nohy a ruce z profilu, oči a tělo zpředu
• Písmo – hieroglyfy, hieratické – kněžské, posvátné, démotické – lidové. Rozluštěno 1822
Francouzem J.F.Champollionem
Věda
• Astronomie – ...
postavy – hlava, nohy a ruce z profilu, oči a tělo zpředu
• Písmo – hieroglyfy, hieratické – kněžské, posvátné, démotické – lidové. Rozluštěno 1822
Francouzem J.F.Champollionem
Věda
• Astronomie – ...
Plnicí modul Laddomat® 21
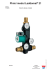 Laddomat 21 musí být vždy připojen ve svislé poloze, jak
je to znázorněno na nákresech.
Umístěte Laddomat 21 do blízkosti kotle a na úroveň výpusti z jeho dna, ne však výše než cca 20 cm nad podlah...
Laddomat 21 musí být vždy připojen ve svislé poloze, jak
je to znázorněno na nákresech.
Umístěte Laddomat 21 do blízkosti kotle a na úroveň výpusti z jeho dna, ne však výše než cca 20 cm nad podlah...
Elektrochemie
 Potenciometrické měření pH je založeno na měření rovnovážného elektromotorického napětí
galvanického článku tvořeného dvěma elektrodami ponořenými do měřeného roztoku. Jedna
elektroda je srovnávací...
Potenciometrické měření pH je založeno na měření rovnovážného elektromotorického napětí
galvanického článku tvořeného dvěma elektrodami ponořenými do měřeného roztoku. Jedna
elektroda je srovnávací...
NÁVOD - Purity Control
 Montáž vícefunkčního ventilu je velmi jednoduchá. Vyšroubujte žlutou zátku na horní
straně čerpadlové hlavy a do hlavy zašroubujte vícefunkční ventil. Dotáhněte o 1/8 1/4 otáčky, aby byla zajištěna...
Montáž vícefunkčního ventilu je velmi jednoduchá. Vyšroubujte žlutou zátku na horní
straně čerpadlové hlavy a do hlavy zašroubujte vícefunkční ventil. Dotáhněte o 1/8 1/4 otáčky, aby byla zajištěna...
q7-30-norso/e
 Výměnu anodové tyče smí provést jen pracovník autorizované servisní organizace. Anodová tyč nesmí být odstraněna bez náhrady! Nádrž by tak mohla zůstat bez ochrany proti elektrolytické korozi a tak...
Výměnu anodové tyče smí provést jen pracovník autorizované servisní organizace. Anodová tyč nesmí být odstraněna bez náhrady! Nádrž by tak mohla zůstat bez ochrany proti elektrolytické korozi a tak...

