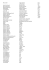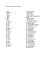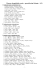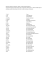Halogenidy název vzorec název vzorec 1. SbF5 1. PbCl4 2. SbF3 2
Transkript
Halogenidy název vzorec název vzorec 1. SbF5 1. PbCl4 2. SbF3 2
Halogenidy název 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. 16. 17. 18. 19. 20. 21. 22. 23. 24. 25. 26. 27. 28. 29. 30. 31. 32. 33. 34. 35. 36. 37. 38. 39. 40. vzorec SbF5 SbF3 AsF5 AsF3 BaF2 BF3 BrF5 BrF3 SnF2 SnF4 KF PF5 PF3 AlF3 MgF2 ClF5 IF5 IF7 SiF4 LiF SF6 SF4 NaF CaF2 XeF6 SbCl5 SbCl3 AsCl3 BaCl2 BeCl2 BCl3 SnCl2 SnCl4 KCl PCl5 PCl3 AlCl3 MgCl2 LiCl název 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. 16. 17. 18. 19. 20. 21. 22. 23. 24. 25. 26. 27. 28. 29. 30. 31. 32. 33. 34. 35. 36. 37. 38. 39. 40. vzorec PbCl4 PbCl2 SCl4 NaCl CaCl2 SbBr3 AsBr3 BeBr2 BBr3 SnBr2 SnBr4 KBr PBr5 PBr3 AlBr3 MgBr2 SiBr4 LiBr NaBr CaBr2 SbI3 AsI3 BaI2 BI3 SnI2 SnI4 KI PI3 AlI3 MgI2 LiI PbI2 NaI CaI2
Podobné dokumenty
PL - VYČÍSLOVÁNÍ ROVNIC
 Pracovní list:
Vyčísli rovnice:
HgO → Hg + O2
S + O2 → SO2
C + O2 → CO2
Ca + O2 → CaO
Fe + 3 O2 → Fe2O3
Cu + O2 → CuO
H2 + Cl2 → HCl
Na + HCl → H2 + NaCl
Zn + HCl → ZnCl2 + H2
CuO + HCl → H2O + CuCl2
Pracovní list:
Vyčísli rovnice:
HgO → Hg + O2
S + O2 → SO2
C + O2 → CO2
Ca + O2 → CaO
Fe + 3 O2 → Fe2O3
Cu + O2 → CuO
H2 + Cl2 → HCl
Na + HCl → H2 + NaCl
Zn + HCl → ZnCl2 + H2
CuO + HCl → H2O + CuCl2
A B oxid vápenatý oxid křemičitý sulfid sodný chlorid barnatý jodid
 sulfid arseničný
bromid vápenatý
oxid molybdenový
oxid uhelnatý
chlorid železitý
SiO2
PCl5
FeS
Li2O
CuCl2
sulfid arseničný
bromid vápenatý
oxid molybdenový
oxid uhelnatý
chlorid železitý
SiO2
PCl5
FeS
Li2O
CuCl2
3 - Katedra chemie FP TUL
 Příprava:
B2O3 + 3 C + 3 Cl2 (Br2) 2 BCl3 (BBr3) + 3 CO
– redukční halogenace
Vlastnosti:
deficit elektronů na B – Lewisovy kyseliny
BX3 + 3H2O H3BO3 + 3 HX
Příprava:
B2O3 + 3 C + 3 Cl2 (Br2) 2 BCl3 (BBr3) + 3 CO
– redukční halogenace
Vlastnosti:
deficit elektronů na B – Lewisovy kyseliny
BX3 + 3H2O H3BO3 + 3 HX
 1. Zn(ClO4)2.6H2O
1. Zn(ClO4)2.6H2O

 KH2PO4
KH2PO4
 atomy halogenů mají v halogenidech vždy oxidační číslo -I ( X -I)
atomy halogenů mají v halogenidech vždy oxidační číslo -I ( X -I)

 5 - indukční ohřev
6 - posuvná tyč
7 - ochranná stěna
5 - indukční ohřev
6 - posuvná tyč
7 - ochranná stěna
 VY 32 INOVACE III.2.2/0301
VY 32 INOVACE III.2.2/0301