DVOUPRVKOVÉ SLOUČENINY
Transkript
DVOUPRVKOVÉ SLOUČENINY Jsou to sloučeniny složené ze dvou prvků. Jejich podstatné jméno má koncovku –id. Patří sem oxidy, sulfidy , halogenidy aj. OXIDY Jsou to dvouprvkové sloučeniny kyslíku a dalšího prvku. Atomy kyslíku mají oxidační číslo – II. Oxidační číslo – píše se římskou číslicí vpravo nahoru, může být kladné, záporné nebo nulové (pokud stojí prvek samostatně). Pravidla tvorby názvosloví (Emil Votoček): A. tvorba vzorce: 1. název je dvouslovný a pořadí prvků v názvu je opačné než ve vzorci. Oxid uhličitý C O 2. oxidační číslo atomu prvku sloučeného s kyslíkem se vyjadřuje různým zakončením přídavného jména a je kladné. I II III IV V VI VII VIII - ný oxid dusný -natý oxid vápenatý -itý oxid železitý -ičitý oxid uhličitý - ičný oxid dusičný -ečný oxid fosforečný -ový oxid sírový -istý oxid manganistý -ičelý oxid osmičelý N 2O CaO Al2O3 CO2 N2O5 P2O5 SO3 Mn2O7 OsO4 3. Použijeme křížové pravidlo → hodnotu ox. Čísla zapíšeme k atomu vázaného prvku C IV2 O-II 4 4. Pokud jdou čísla za atomy vázaných prvků krátit → zjednodušíme je na základní tvar. C2O4 → CO2 5. Provedeme kontrolu → součet oxidačních čísel musí být roven nule. B. tvorba názvu 1. Zapíšeme oxidační čísla atomu kyslíku v oxidu Cl2O7-II 2. Z poměrů atomů vázaných v oxidu určíme oxidační číslo atomu druhého prvku Cl2VIIO7-II 7 x –II = 14 14: 2 = 7→ VII 3. K názvu druhého prvku přidáme zakončení, které odpovídá ox. Číslu jeho atomu → získáme přídavné jméno VII → istý→ chloristý 4. Přidáme ho k podstatnému jménu oxid → oxid chloristý Významné oxidy Oxid siřičitý- bezbarvý, ostře zapáchající plyn, je toxický, vzniká při hoření síry Používá se při výrobě celulózy a papíru, k bělení, dezinfekci, Meziprodukt při výrobě kyseliny sírové, podílí se na kyselých Deštích Oxidy dusíku –dusnatý- bezbarvý, dusičitý- hnědočervený, vznikají činností Spalovacích motorů a působí škodlivě na ovzduší, meziprodukt Při výrobě kyseliny dusičné, tvoří kyselé deště Oxid uhelnatý – bezbarvý velmi jedovatý plyn, vzniká hořením uhlíkatých látek Při nedostatku kyslíku, jedovatá složka kouřových, výfukových Plynů a cigaret Oxid uhličitý- plynná nedýchatelná bezbarvá látka, má větší hustotu než vzduch, Je důležitý pro fotosyntézu, používá se v chladících zařízeních, V hasících přístrojích, podílí se na skleníkovém efektu Oxid vápenatý- pevná bílá prášková látka, vyrábí se rozkladem vápence, používá Se pro výrobu hašeného vápna, k vápnění půdy Oxid hlinitý – v přírodě jako korund- safír, rubín, výroba porcelánu, zubních Cementů, barev a hliníku Oxid křemičitý – pevná, těžko tavitelná látka, využívá se ve stavebnictví, Sklářství a hutnictví SULFIDY Jsou to dvouprvkové sloučeniny síry a kovového prvku. Atom síry má oxidační číslo -II Názvosloví je obdobné jako u oxidů. Sulfidy tvoří v přírodě nerosty → suroviny pro výrobu kovů. Galenit –(sulfid olovnatý), je stříbřitě šedý a krystalický- výroba olova Sfalerit – (sulfid zinečnatý)- hnědé, černé i žluté krystalky- výroba zinku a Výroba luminoforů (pohlcují určité druhy záření A vydávají je ve formě světla) Sulfan –zastarale sirovodík, bezbarvá, odporně páchnoucí jedovatý plyn HALOGENIDY Jsou to dvouprvkové sloučeniny halogenů- F,Cl, Br, I a jiných prvků, oxidační číslo halogenů je –I. Halogenovodíky – dvouprvkové sloučeniny halogenu a vodíku HF- fluorovodík HCl – chlorovodík HBr- bromovodík HI- jodovodík Chlorid sodný – bezbarvá krystalická látka, dobře rozpustná ve vodě → kuch. Sůl (nezbytná složka potravy), slouží ke konzervaci potravin, Výroba chloru, hydroxidu sodného, mýdla, solení silnic aj. Fluorid vápenatý – kazivec, je krystalický, používá se v hutnictví a na výrobu Fluorovodíku Bromid stříbrný – je citlivý na světlo → výroba fotografických materiálů
Podobné dokumenty
II.1.3-CHEMICKÉ VZORCE
 -ičitý
-itý
-itý
-ičitý
-ičný, -ečný
-ičný, -ečný
-ový
-istý
-istý
-ový
-ičelý
-ičelý
-ičitý
-itý
-itý
-ičitý
-ičný, -ečný
-ičný, -ečný
-ový
-istý
-istý
-ový
-ičelý
-ičelý
ke stažení - jarjurek.cz
 (plus) se nepíše, záporné znaménko (minus) se píše před římským číslem.
Ve dvouprvkových sloučeninách mají vždy atomy jednoho prvku kladné oxidační číslo a atomy druhého prvku
záporné oxidační čísl...
(plus) se nepíše, záporné znaménko (minus) se píše před římským číslem.
Ve dvouprvkových sloučeninách mají vždy atomy jednoho prvku kladné oxidační číslo a atomy druhého prvku
záporné oxidační čísl...
Zemská kůra - Katedra sklářských strojů a robotiky
 • Anorganickou (vše ostatní).
Oxidy
Oxidy dělíme na:
o zásadotvorné (oxidy, jejichž sloučeniny s vodou jsou zásady);
o kyselinotvorné (oxidy, jejichž sloučeniny s vodou jsou kyseliny);
o amfoterní ...
• Anorganickou (vše ostatní).
Oxidy
Oxidy dělíme na:
o zásadotvorné (oxidy, jejichž sloučeniny s vodou jsou zásady);
o kyselinotvorné (oxidy, jejichž sloučeniny s vodou jsou kyseliny);
o amfoterní ...
oxid vanadičný oxid křemičitý oxid draselný oxid boritý oxid
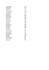 oxid vanadičný
oxid křemičitý
oxid draselný
oxid boritý
oxid wolframový
oxid manganatý
oxid uhličitý
oxid chloristý
oxid dusičný
oxid chromový
oxid osmičelý
oxid hlinitý
oxid barnatý
oxid uhelnatý
...
oxid vanadičný
oxid křemičitý
oxid draselný
oxid boritý
oxid wolframový
oxid manganatý
oxid uhličitý
oxid chloristý
oxid dusičný
oxid chromový
oxid osmičelý
oxid hlinitý
oxid barnatý
oxid uhelnatý
...
 12. oxid chloristý
12. oxid chloristý
 HYDROXIDY
KOMPLEXNÍ SLOUČENINY
HYDROXIDY
KOMPLEXNÍ SLOUČENINY
 chlorid olovnatý
sulfid stříbrný
oxid sirnatý
Sn(OH)4
Br2O
Mn2O3
FeBr3
SnS2
chlorid olovnatý
sulfid stříbrný
oxid sirnatý
Sn(OH)4
Br2O
Mn2O3
FeBr3
SnS2
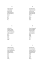 Mn2O7
K2S
FeCl3
NaF
N2O5
Mn2O7
K2S
FeCl3
NaF
N2O5









