Chemické reakce v anorganické a organické chemii - Studijni
Transkript
Na www.studijni-svet.cz zaslal(a): Jakub0002 Chemické reakce v anorganické a organické chemii Chemická reakce je děj, při kterém na straně reaktantů vazby zanikají a na straně produktů vznikají vazby nové. Dochází k ní, při změně vnějších podmínek (přidání energie, změna tlaku) nebo přidáním činidla. Reaktanty spolu začnou reagovat a přeměňovat se na produkty – látky s energeticky výhodnější strukturou. Reaktanty = výchozí látky, které vstupují do chemické reakce Produkty = látky nově vzniklé, vystupující z reakce Třídění chemických reakcí 1) Podle vnějších změn a) Skladné (syntéza) - z jednodušších látek vznikají složitější H2 + Cl2 → 2HCl b) Rozkladné (analýza) - ze složitějších látek vznikají jednodušší 2H2O2 → O2 + 2H2O c) Substituční (vytěsňování) - atom nebo skupina je v molekule vytěsněna jiným atomem nebo skupinou Zn + 2HCl H2 + ZnCl2 d) Podvojná záměna (konverze) - výměna atomů nebo skupin mezi molekulami Neutralizace H2SO4 + NaOH H2O + Na2So4 Srážecí reakce Jedním produktem je ve vodě nerozpustná sraženina (↓) BaCl2 + Na2SO4 BaSO4 + 2NaCl Vytěsňování slabší kyseliny z její soli silnější kyselinou CaCO3 + 2HCl CaCl2 + H2CO3 2) Podle skupenství reaktantů pevné… s (solidus) a) Homogenní kapalné… l (liquidus) - všechny reaktanty ve stejném skupenství (g) (g) (l) plynné… g (galeus) 2H2 + O2 2H2O vodný roztok … ag b) Heterogenní - Jeden z reaktantů má jiné skupenství než ostatní Zn(s) + 2HCl(ag) ZnCl2(ag) + H2(g) 3) Podle přenášených částic a) Acidobazické (syntéza) - reakce kyseliny a zásady, při níž je přenášen proton v podobě kationtu vodíku H+ - mnoho druhů, např. neutralizace – reakce kyseliny s hydroxidem za vzniku soli a vody HCl + NaOH → NaCl + H2O b) Redoxní - přenášen elektron e-, mění se oxidační čísla prvků o oxidace – zvyšování oxidačního čísla, ztráta elektronu o redukce – zmenšení oxidačního čísla, příjem elektronu oxidace s redukcí probíhají současně, stejný počet poskytnutých i přijatých elektronů redukční činidlo – prvek, který se oxiduje oxidační činidlo – prvek, který se redukuje 2Al0 + 6H+ICl-I→ 2Al+IIICl3-I + 3H20 c) Komplexotvorné - přenášeny celé elektronové páry – reakce mezi donorem a akceptorem - vznikají komplexy a cheláty AgCl + 2 NH3→ [Ag(NH3)2]Cl 4) Podle tepelné změny a) Exotermní - teplo se uvolňuje CaO + H2O → Ca(OH)2 - hašení vápna b) Endotermní - teplo se spotřebovává CaCO3 →CaO + CO2 - tvrdnutí vápna Reakce v organické chemii Substrát = výchozí látka, která nás zajímá a která v průběhu chemické reakce podléhá změnám (většinou ta složitější) Činidlo = výchozí látka, která reaguje s různými substráty stejným způsobem. 1) Homolitické činidlo – vzniká při homolýze (syntetické štěpení) - výsledkem radikál R–R (+světlo, teplo)→ R. + R. 2) Heterolytické činidlo – vzniká při heterolýze (asymetrické štěpení) - výsledkem ionty H-Cl → H+ + Clelektrofilní nukleofilní Redoxní reakce v organice 1) Oxidace (dehydrogenace) - získání kyslíku (oxygenace) nebo ztráta vodíku (dehydrogenace) - hoření je prudká oxidace, silná exotermní reakce C10H8 + 12 O2 → 10 CO2 + 4 H2O 2) Redukce - získávání vodíku (hydrogenace) nebo ztráta kyslíku (deoxygenace) CH2 = CHCH3 + H2 → CH3CH2CH3 Reakce podle reakčního mechanismu 1) Adice -zanikají vazby snižuje se násobnost vazeb CH2=CH2 + Cl2 CH2Cl – CH2Cl 2) Eliminace - opak adice, dochází k odštěpení jednoduché anorganické sloučeniny a současně se tvoří násobná vazba CH3 – CH2Cl CH2=CH2 + HCl a) Dehydratace – odštěpení molekuly vody b) Dehydrogenace – odštěpují se atomy vodíku c) Dehydrohalogenace – odštěpují se molekuly halogenvodíku 3) Substituce - atom nebo skupina zaměněna za jiný atom nebo skupinu atomů, násobnost vazby se nemění 4) Přesmyk - reakce uvnitř jedné molekuly, izomerační reakce, při níž dochází k přeskupení atomů uvnitř molekuly
Podobné dokumenty
5. chemické reakce - Studijni
 2NaOH + H2SO4 -> Na2SO4 + 2H2O
Oxidačně redukční reakce – přenos elektronů => změna oxid. Čísel
Zn° + S° -> ZnS
Koordinační reakce – tvorba koordinačně – kovalentní vazby
NaOH + Al(OH)3 -> Na[Al(OH...
2NaOH + H2SO4 -> Na2SO4 + 2H2O
Oxidačně redukční reakce – přenos elektronů => změna oxid. Čísel
Zn° + S° -> ZnS
Koordinační reakce – tvorba koordinačně – kovalentní vazby
NaOH + Al(OH)3 -> Na[Al(OH...
Kristýna Anna Rolníková období vytvoření
 9. Uveď min. 5 příkladů chemických reakcí, se kterými se setkáváš v běžném životě.
9. Uveď min. 5 příkladů chemických reakcí, se kterými se setkáváš v běžném životě.
Uhlovodíky s více násobnými vazbami
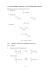 2) Molární refrakce
Typická exaltace mol. refrakce – hodnota mol. refrakce je vyšší než součet
jednotlivých inkrementů (jak je tomu, jsou-li vazby isolované)
3) Absorpce v UV oblasti
Nastává posun ...
2) Molární refrakce
Typická exaltace mol. refrakce – hodnota mol. refrakce je vyšší než součet
jednotlivých inkrementů (jak je tomu, jsou-li vazby isolované)
3) Absorpce v UV oblasti
Nastává posun ...
Halogeny a jejich sloučeniny
 Se solemi slabých kyselin vytěsní svůj oxid, popř. kyselinu.
2HCl CaCO
CO
CaCl
H O,
2HCl Na SO
SO
2NaCl H O,
2HCl FeS H S FeCl ,
HCl KCN HCN KCl.
Se solemi slabých kyselin vytěsní svůj oxid, popř. kyselinu.
2HCl CaCO
CO
CaCl
H O,
2HCl Na SO
SO
2NaCl H O,
2HCl FeS H S FeCl ,
HCl KCN HCN KCl.
ALKENY
 – patřı́ mezi nejvýznamějšı́ suroviny chem. průmyslu, vyrábı́ se z něj polyethylen, ethanol ..
– nejjednoduššı́ rostlinný hormon (urychluje zránı́ ovoce, ovlivňuje odbourávánı́ chloro...
– patřı́ mezi nejvýznamějšı́ suroviny chem. průmyslu, vyrábı́ se z něj polyethylen, ethanol ..
– nejjednoduššı́ rostlinný hormon (urychluje zránı́ ovoce, ovlivňuje odbourávánı́ chloro...
VY_32_INOVACE_PZA_209 Ing. Radka Vydrová Obchodní
 J. ŠKODA, P. Doulík. Chemie: učebnice pro základní školy 9 a víceletá gymnázia. Plzeň: Fraus, 2007.
J. ŠKODA, P. Doulík. Chemie: učebnice pro základní školy 9 a víceletá gymnázia. Plzeň: Fraus, 2007.
Chemické reakce a rovnice
 energii, nikoliv hmotu. Reakce v zatavené ampuli.
Izolovaná. Neumožňuje vyměňovat s okolím ani
hmotu ani energii. Reakce v uzavřeném, tepelně
izolovaném autoklávu.
energii, nikoliv hmotu. Reakce v zatavené ampuli.
Izolovaná. Neumožňuje vyměňovat s okolím ani
hmotu ani energii. Reakce v uzavřeném, tepelně
izolovaném autoklávu.



