Redoxní reakce
Transkript
Redoxní reakce 1 Redukce je přijímání elektronů, oxidační číslo prvku se snižuje Aox + ne- Ared Oxidace je odebírání elektronů, oxidační číslo prvku se zvyšuje Bred - ne- Box Spojením obou dílčích rovnováh dostáváme redoxní rovnováhu Aox + Bred Box + Ared Aox/Ared i Bred/Box se liší o n elektronů, jsou to redoxní páry Redoxní reakce solný můstek Zn + Cu2+ Zn2+ + Cu 2 Redoxní reakce Je - li kov (kovová elektroda) ponořen do roztoku svých iontů, ustaví se redoxní rovnováha Mn+ + ne- M Tato redoxní rovnováha odpovídá elektrodovému potenciálu E (V) RT E = E0 + ln a( M n + ) nF E0 je standardní elektrodový potenciál, R molární plynová konstanta, T teplota (K), n počet vyměněných elektronů, F Faradayova konstanta, a(Mn+) aktivita iontu 3 Redoxní reakce 4 Rovnici lze pro T = 298 K (25 °C), vyčíslením F = 96500 C mol -1 a R = 8,314 J K-1 mol-1, převedení ln na log a použitím koncentrací látek zjednodušit (Eo je formální elektrodový potenciál) 0,059 E=E + log c ( M n + ) n o Elektrodový potenciál nelze přímo měřit, lze měřit pouze rozdíly mezi dvěmi elektrodami. Za základ byl vzat elektrodový potenciál standardní vodíkové elektrody, jehož hodnota byla určena na 0,000 V. Redoxní reakce Dle standardního elektrodového potenciálu lze vytvořit řadu napětí kovů. Jedná se o standardní potenciály dílčí redoxní reakce Mn+ + neRedoxní pár Li+/Li Ba2+/Ba Na+/Na Mg2+/Mg Al3+/Al Zn2+/Zn Fe2+/Fe E0 (V) - 3,04 - 2,91 - 2,71 - 2,36 - 1,66 - 0,76 - 0,44 M Redoxní pár 2 H+/H2 Cu2+/Cu Cu+/Cu Hg22+/Hg Au3+/Au E0 (V) 0,00 + 0,34 + 0,52 + 0,80 + 1,42 Je - li E0< 0 jsou to kovy neušlechtilé, rozpouští se v neoxidujících kyselinách za vývoje vodíku. Je - li E0 > 0 jsou to kovy ušlechtilé, rozpouští se v oxidujících kyselinách, bez vývoje vodíku. 5 Redoxní reakce 5 V obecném případě pro dílčí redoxní rovnováhu Aox + ne- Ared Platí pro elektrodový potenciál (Nernst - Petersson): E = E0 + RT a ( Aox ) ln nF a ( Ared ) A po úpravě: E = E o + 0,059 log c( Aox ) n c( Ared ) Čím je elektrodový potenciál větší, tím je daný redoxní systém silnější oxidovadlo, např.: MnO4- + 2 H2O + 3 eCr2O72- + 14 H+ + 6 eMnO4- + 8 H+ + 5 e- MnO2 + 4 OH2 Cr3+ + 7 H2O Mn2+ + 2 H2O E0 = + 0,59 V E0 = + 1,33 V E0 = + 1,51 V Komplexotvorné reakce 1 Komplexní sloučenina je molekula nebo ion. Skládá se z centrálního iontu, na který se koordinačně kovalentní vazbou váží ligandy. Centrální ionty jsou většinou kovy, vystupují ve formě kationtů. Ligandy jsou anionty nebo elektroneutrální molekuly. Počet ligandů převyšuje obvyklé oxidační číslo centrálního iontu. Ligandy se mohou vázat jedním elektronovým párem, pak jsou monodonorové, nebo více páry, polydonorové. Polydonorové mohou tvořit cyklické komplexy - cheláty. Rovnováhu děje M+nL Lze popsat asociační konstantou MLn [ MLn ] βn = [M ][L]n Čím je hodnota konstanty větší, tím je komplex stabilnější. Komplexotvorné reakce Komplex EDTA - kov 2 Chlorofyl Chlorofyl a * CH3; Chlorofyl b * CHO Srážecí reakce 1 Srážecí reakce jsou iontové reakce, při nichž vznikají málo rozpustné látky, které se z roztoku vylučují v tuhé fázi, ve formě sraženiny. Součin rozpustnosti KS MkXa k Ma+ + a Xk- K S = [M ] [X ] k a pK S = − log K S Vylučování sraženiny nastane až tehdy, je - li hodnota KS překročena. Pokud součinu rozpustnosti není dosaženo, sraženina se nevyloučí. Čím je KS menší (tedy pKS větší) tím méně je látka za daných podmínek rozpustná. Látka AgCl AgBr AgI CaCO3 pKS 9,75 12,31 16,08 8,30 Látka Ca3(PO4)2 CaHPO4 CaC2O4 . H2O BaCO3 pKS 26 6,56 8,58 8,29 Látka Fe(OH)3 MgCO3 HgS Ag2S pKS 39,43 9,30 51,8 49,2
Podobné dokumenty
Ramaddii J Shigux Geleta
 ¢¿f| pU‹ ²Êq cLa B›nu ¥K¸‘é ©öF ¢DM;
¢‘¥{ó‘é ´}nq 20 ¥S−‘é} ©X´ k…ªï] ©X´ ‰KoŠoë kcX ¢[fd …lq ¢C{‘é} ¢
©X´ ]X…q …F©K[[M kïlF Ae} KŠ©ö …§C}M; ©X´} »MY ‰[éM kÌq †}
© KŸ²X o¸mkc‘éloh‘é ©Loh‘é} [ïn·ké·...
¢¿f| pU‹ ²Êq cLa B›nu ¥K¸‘é ©öF ¢DM;
¢‘¥{ó‘é ´}nq 20 ¥S−‘é} ©X´ k…ªï] ©X´ ‰KoŠoë kcX ¢[fd …lq ¢C{‘é} ¢
©X´ ]X…q …F©K[[M kïlF Ae} KŠ©ö …§C}M; ©X´} »MY ‰[éM kÌq †}
© KŸ²X o¸mkc‘éloh‘é ©Loh‘é} [ïn·ké·...
Úpravy chemických rovnic – procvičování (kvinta + 1.G)
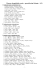 53. 2 P4 + 3 Ba(OH)2 + 6 H2O 2 PH3 + 3 Ba(H2PO2)2
54. 3 Ag + 4 HNO3 (z e .) 3 AgNO3 + NO + 2 H2O
55. 4 KClO3 3 KClO4 + KCl
56. 3 Hg + 8 HNO3 (z e .)
3 Hg(NO3)2 + 2 NO + 4 H2O
57. Cu + 2 H2SO4 (konc...
53. 2 P4 + 3 Ba(OH)2 + 6 H2O 2 PH3 + 3 Ba(H2PO2)2
54. 3 Ag + 4 HNO3 (z e .) 3 AgNO3 + NO + 2 H2O
55. 4 KClO3 3 KClO4 + KCl
56. 3 Hg + 8 HNO3 (z e .)
3 Hg(NO3)2 + 2 NO + 4 H2O
57. Cu + 2 H2SO4 (konc...
Závody spřežení Čakovičky 2016 Dvojspřeží
 Hlavní rozhodčí: Matoušková Ilona (F0576)
Chvapil Jaroslav (B0586,RZ), Václav Marek (A0093,RZ), Veselý Jiří (G0277,RZ), Lišťák Petr
Členové:
(G1193,RZ), Jiří Holubář (G1214,KM), Kocman Luboš (C0344...
Hlavní rozhodčí: Matoušková Ilona (F0576)
Chvapil Jaroslav (B0586,RZ), Václav Marek (A0093,RZ), Veselý Jiří (G0277,RZ), Lišťák Petr
Členové:
(G1193,RZ), Jiří Holubář (G1214,KM), Kocman Luboš (C0344...
Chemické rovnováhy
 1. Amoniak je při teplotě 400°C a tlaku 1 MPa z 98% disociován. Vypočítejte Kp této reakce:
2 NH 3 (g )→ N 2 (g )+ 3 H 2( g).
[Kp = 9,93.1014]
2. Kolik gramů ethylesteru kyseliny octové je možno zí...
1. Amoniak je při teplotě 400°C a tlaku 1 MPa z 98% disociován. Vypočítejte Kp této reakce:
2 NH 3 (g )→ N 2 (g )+ 3 H 2( g).
[Kp = 9,93.1014]
2. Kolik gramů ethylesteru kyseliny octové je možno zí...
Chemie kappa: Podmínka A5 – hmotnostní vztahy v chemii, poměry
 nebude cokoliv jasné, prosím přijďte za mnou konzultovat konkrétní příklady a nejlépe přímo
problematická místa. Vzorové příklady, včetně řešení, můžete najít také v učebnici chemie pro
nebude cokoliv jasné, prosím přijďte za mnou konzultovat konkrétní příklady a nejlépe přímo
problematická místa. Vzorové příklady, včetně řešení, můžete najít také v učebnici chemie pro
Tabulka 8
 2. Z navážky vzorku 2,6735 g byl po rozpuštění vysrážen arzen jako Ag3AsO4. Ten byl po odfiltrování a
promytí rozpuštěn v HNO3 a ionty Ag+ vysráženy jako AgCl. Vypočítejte procentový obsah As2O5 ve...
2. Z navážky vzorku 2,6735 g byl po rozpuštění vysrážen arzen jako Ag3AsO4. Ten byl po odfiltrování a
promytí rozpuštěn v HNO3 a ionty Ag+ vysráženy jako AgCl. Vypočítejte procentový obsah As2O5 ve...
Základy fyziologie
 je potenciál na vnitřní straně membrány,
je potenciál na vnější straně membrány
• činností buněčné membrány a sodíko-draslíkové
pumpy dochází ke změně koncentrace iontů,
především K+, Na+ a Cl-, uv...
je potenciál na vnitřní straně membrány,
je potenciál na vnější straně membrány
• činností buněčné membrány a sodíko-draslíkové
pumpy dochází ke změně koncentrace iontů,
především K+, Na+ a Cl-, uv...