2010 - Moderní biofyzikální přístupy v experimentální biologii
Transkript
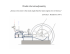
MODERNÍ BIOFYZIKÁLNÍ METODY: POKROČILÉ PRAKTICKÉ VZDĚLÁVÁNÍ V EXPERIMENTÁLNÍ BIOLOGII Operační program Vzdělávání pro konkurenceschopnost Číslo projektu: CZ.1.07/2.3.00/09.0046 Praktický kurz základních metod experimentální biologie konaný na Katedře biologie a ekologie Přírodovědecké fakulty Ostravské univerzity v Ostravě v termínu 31. 5. – 4. 6. 2010 Program praktického kurzu 9 - 10 dopoledne odpoledne Pondělí Úterý Středa Čtvrtek Pátek přednáška přednáška přednáška přednáška přednáška Izolace DNA pomocí kolonek. Spektrofotometrické stanovení koncentrace a čistoty DNA. Mikrobiologie: Izolace mikroorganismů na selektivně diagnostických médiích. Restrikční štěpení plasmidové DNA, elektroforéza restrikčních fragmentů. Mikrobiologie: Mikroskopování kvasinek. Barvení buněčných organel a struktur. Detekce interakce DNA-protein pomocí EMSA. Vakuový blot. Imunodetekce proteinů na membránách. Transformace buněk plasmidovou DNA . Selekce buněk s rekombinantním plasmidem. PAGE proteinů Elektroforetický přenos proteinů na membránu. Vyhodnocení výsledků, hodnocení kurzu účastníky. Elektroaktivita a povrchová aktivita NK, vliv struktury NK; denaturace DNA v roztoku a na povrchu elektrody, předdenaturační přechody. Analýza poškození DNA pomocí elektrochemických metod. Specifické metody barvení a kultivace Téma: Selektivně diagnostické půdy Úkol: Izolace na selektivně diagnostických médiích Diagnostické kultivační půdy bývají také označovány jako půdy rozpoznávací. Dovolují odlišit mikroorganismy s určitou fyziologickou nebo biochemickou vlastností od těch, které tuto vlastnost či znak postrádají. Většinou se připravují tak, že k univerzálním půdám se přidávají určité látky, jejichž rozklad, redukci a jinou změnu můžeme sledovat buď přímo, nebo pomocí přidaného indikátoru či vhodného činidla až po skončení kultivace. Kultivační půdy selektivní potlačují růst průvodní mikroflóry, a tím současně umožňují lepší růst mikroorganismům prokazovaným. Potlačení růstu je možné způsobit vhodnými mikrobistatickými látkami (působením barviv, žlučových solí, antibiotik i inhibitorů brzdících metabolismus potlačovaných bakterií) nebo fyzikálně chemickými vlastnostmi selektivního média (např. nižší hodnotou pH). V současné době jsou ve velké míře používány půdy selektivně diagnostické vytvořené vhodnou kombinací půdy diagnostických. Desoxycholát-citrát-laktóza agar DC agar je selektivní médium pro rody Salmonella, Shigella. Inhibuje růst grampozitivních koků a částečně inhibuje růst rodů Klebsiella, Enterobacter, Citrobacter, případně jiné. Zamezuje plazení rodu Proteus. MacConkey agar MacConkey agar je určen pro izolaci enterobakterií z klinického materiálu a počítání enterobakterií v potravinách, mléčných výrobcích a ve vodě. Používá se také pro detekci enteropatogenních druhů Salmonella, Shigella a E. coli u dětí a v mateřském mléce. Krystalová violeť inhibuje růst grampozitivních koků. Endo agar Pro detekci a rozlišení laktosa-pozitivních a laktosa-negativních koliformních bakterií. Krevní agar Krevní agar se používá k vyšetření většiny klinických vzorků. Roste na něm naprostá většina lékařsky důležitých mikroorganismů. Umožňuje sledovat hemolytické vlastnosti vypěstovaných kmenů a podle nich je diagnostikovat. Slanetz-Bartley agar Pro detekci a stanovení Enterococců. Materiál: 6-dílné kultivační destičky, klička. Kultury: E. coli, Enterobacter aerogenes, Enterococcus faecium, Proteus vulgaris, Salmonella typhimurium, Pseudomonas aeruginosa, Streptococcus salivarius Postup práce: 1. Jednotlivé části kultivační destičky popište. 2. Na části kultivačních destiček naočkujte příslušné kmeny. A. Destička DC/MC: Salmonella Proteus / Pseudomonas E. coli B. Destička KAg/Endo agar: Streptococcus Salmonella Proteus / Pseudomonas C. Destička KAg/Endo agar/SB: E. coli / Enterobacter Enterococcus 3. Destičky inkubujte při 37°C přes noc. Hodnocení výsledků: Do tabulek přehledně zaznamenejte výsledky. Všímejte si intenzity nárůstu, barevných změn kolonií a půdy v jejich okolí a případně dalších zvláštností. U použitých medií prostudujte složení, porovnejte složení u jednotlivých médií a pokuste se charakterizovat podstatu jejich selekčního účinku. Vyvoďte závěry, pro které kultury jsou ta která média selektivní. Uveďte, jaký význam mají selektivní média v mikrobiologické praxi. Téma: Mikroskopování kvasinek Úkol č. 1: Test vitality Test využívá semipermeability cytoplazmatické membrány. Živé buňky mají zbarvenu pouze buněčnou stěnu, proto se jeví jako světle modré. Mrtvé buňky jsou zbarveny intenzívně modře, neboť jejich membránový systém je narušen. Pro kontrolu vybarvení mrtvých buněk připravujeme vedle vitálně barveného preparátu také preparát barvený po fixaci plamenem. Materiál: Podložní a krycí sklo, methylenová modř, klička, pipety, filtrační papír, mikroskop. Kultury: Saccharomyces cerevisiae Postup práce: 1. Z pekařských kvasnic připravíme ve zkumavce se sterilní destilovanou vodou řídkou suspenzi. 2. Pipetou přeneseme malou kapku kultury na podložní sklíčko. 3. Rozetřeme do nátěru a necháme na vzduchu dobře zaschnout. 4. Přidáme kapku methylenové modři. 5. Ihned přikryjeme krycím sklem. Pokud se nám zdá preparát málo zbarven, lze k hraně krycího skla přikapávat barvivo, přičemž z druhé strany jej odsáváme proužkem filtračního papíru. 6. V 10 zorných polích spočítáme počet živých a mrtvých buněk. POZOR! Pracujte rychle, celková doba barvení by měla trvat jen 3 minuty. Přesáhne-li 5 minut, barvivo působí toxicky a všechny buňky budou sytě modré. 6. Připravíme ze suspenze kvasinek ještě jeden preparát. Mikroorganismy v nátěru fixujeme v plameni poněkud déle, aby došlo k úhynu buněk. 7. Barvíme a mikroskopujeme stejně jako v předchozím případě. Hodnocení výsledků: Zakreslete obraz pozorovaný v jednom zorném poli. Vypočítejte % mrtvých kvasinek. Zhodnoťte, zda vámi vyšetřovaná kultura splňuje podmínky stanovené pro využití např. v pivovarnictví, kde platí požadavek, že pro zákvas nesmějí být použity kvasinky, které by obsahovaly více než 5 % mrtvých buněk. Porovnejte preparát nativní s fixovaným. Zaměřte se na podíl mrtvých buněk a na jejich tvar. V závěru diskutujte změny vznikající v důsledku stáří kultury a jejího odumření. Jak byste cytologické změny vysvětlili? Úkol č. 2: Měření velikosti buněk kvasinek Velikost mikroorganismů, tj. šířka a délka buněk, fruktifikačních orgánů, spór a některých buněčných organel, patří k diagnostickým znakům mikroorganismů. Jestliže za stejných podmínek zjistíme, že velikost buněk téže kultury kolísá, stanovíme maximální a minimální hodnoty a jako výsledek uvedeme variační rozpětí (např. 0,4 – 1,2 µm x 3,0 – 6,5 µm). K přesnému zhodnocení velikosti bychom museli proměřit 100 až 200 buněk příslušné kultury. Materiál: Mikroskop, objektivový a okulárový mikrometr, podložní a krycí sklo, methylenová modř, klička, filtrační papír. Kultury: kultura Saccharomyces cerevisiae Postup práce: 1. Připravíme preparát dle úlohy č. 1. 2. Měření provádíme pomocí objektivového a okulárového mikrometru. Postupujeme tak, že před vlastním měřením seřídíme stupnice objektivového a okulárového mikrometru tak, aby obě stupnice ležely v zorném poli rovnoběžně a jejich počátky se ztotožnily. Pak zjistíme, kolik dílků objektivového mikrometru odpovídá dílkům okulárového mikrometru. Odpovídající dílky se musí přesně krýt. Okulárový mikrometr Objektivový mikrometr 3. Vypočteme hodnotu okulárového dílku (H) pro dané zvětšení podle vzorce: H= dílky objektivové x 10 dílky okulárové 4. Při vlastním měření se objektivový mikrometr nepoužívá. Tzn., že ho musíme vyjmout a místo něj umístíme připravený preparát. Pozor! S mikrometrem manipulujte velmi opatrně, ihned jej řádně uložte, aby se nepodřel, neztratil nebo nerozbil! 5. Jednotlivé buňky umístíme do středu zorného pole a natočíme na ně okulárový mikrometr tak, aby bylo možné odečíst délku v dílcích (desetiny dílku odhadujeme). 6. Otáčením okuláru o 90° lze pak stejným způsobem odečíst šířku buňky. 7. Proměříme větší počet buněk a průměrné hodnoty v dílcích se pronásobí zjištěnou hodnotou dílku (H) pro určité zvětšení a výsledky se převedou na µm. Hodnocení výsledků: Proveďte měření velikosti buněk kvasinek. Změřte 10 buněk v daném preparátu. Hodnoty zapisujte do tabulky. Dílky přepočtěte na µm. Buňka 1 2 3 4 5 6 7 8 9 10 Variační rozpětí Délka buňky (µm) Šířka buňky (µm) V závěru se zkuste zamyslet nad příčinami možných rozdílů ve velikosti buněk jedné kultury. Uveďte, čím mohou být způsobeny. Úkol č. 3: Barvení glykogenu a bílkovin Glykogen je důležitá rezervní látka v buňkách mikroorganismů. Buňky v optimálních podmínkách růstu mohou obsahovat až 20 % glykogenu. Rychlost tvorby glykogenu je závislá na podmínkách prostředí a jeho obsah v buňce je v určitém poměru k bílkovinám. Množství glykogenu je nepřímo úměrné množství bílkovin v buňce. Podle množství glykogenu posuzujeme fyziologický stav kultury. Materiál: Mikroskop, podložní a krycí sklo, Lugolův roztok, pipety, filtrační papír. Kultury: třídenní kultura Saccharomyces cerevisiae Postup práce: 1. Na čisté a suché podložní sklíčko přeneseme malou kapku suspenze kvasinek. 2. Přikápneme kapku Lugolova roztoku, promícháme a přikryjeme krycím sklíčkem. 3. Mikroskopujeme za použití imerze. Hodnocení výsledků: Obraz preparátu zakreslete: Zhodnoťte množství glykogenu v kultuře: Žlutě zbarvené části plazmy dokazují přítomnost bílkovin, hnědé a hnědočervené zbarvení nasvědčuje přítomnosti glykogenu. Všimněte si pučících buněk, v pupenech se glykogen nevyskytuje - starší buňky obsahují poměrně velké množství glykogenu. Proveďte důkaz rozpustnosti glykogenu: Podložní sklíčko se zbarveným preparátem zahřejte nad plamenem – hnědé zbarvení zmizí, po opětovném zchlazení se znovu objeví (je potřeba pracovat co nejrychleji – po zahřátí sklíčka ihned pozorovat s imerzí). Úkol č. 4: Barvení tuku Hromadění tuku v buňkách je obvykle projevem stárnutí a degenerace. Tuk může vzniknout jako rezervní látka z bílkovin a glykogenu v případě, kdy buňky hladoví. Materiál: Mikroskop, podložní a krycí sklo, Sudan III, pipety, klička, filtrační papír. Kultury: pětidenní kultura Saccharomyces cerevisiae Postup práce: 1. Na čisté a suché podložní sklíčko přeneseme malou kapku suspenze kvasinek. 2. Přikápneme kapku Sudanu III, smícháme a přikryjeme krycím sklíčkem. 3. Po uplynutí 10-20 min. pozorujeme preparát pod mikroskopem. Hodnocení výsledků: Tukové substance se zbarvují cihlově červeně až hnědě. Úkol č. 5: Barvení volutinu Buňky některých mikroorganismů obsahují rezervní látku volutin. Název pochází od německého mikrobiologa A. Mayera, který volutin objevil u Spirillum volutans. V buňkách se volutin nachází ve tvaru polotekutých zrn různé velikosti. Z hlediska chemického složení je volutin lineárním polyfosfátem (polymetafosfátem) složeným až z 500 molekul trihydrogenfosforečnanů. Volutin je nerozpustný ve vodě, a proto také osmoticky neaktivní. Vazba mezi molekulami trihydrogenfosforečnanů je bohatá na energii a k svému vzniku vyžaduje jednu molekulu ATP. Některé mikroorganismy mohou proto volutinu využívat jako energetického zdroje místo vlastního adenosintrifosfátu. Materiál: Mikroskop, podložní a krycí sklo, methylenová modř, filtrační papír, klička. Kultury: sedmidenní kultura Saccharomyces cerevisiae Postup práce: 1. Na čisté a suché podložní sklíčko přeneseme malou kapku suspenze kvasinek, rozetřeme do nátěru a necháme osušit na vzduchu. 2. Podložní sklo převrstvíme na několik sekund methylenovou modří. 3. Preparát opláchneme tekoucí vodou a osušíme na filtračním papíru. 4. Přikryjeme krycím sklíčkem a pozorujeme pod mikroskopem. Hodnocení výsledků: Barevně zakreslete mikroskopický obraz do protokolu. Zhodnoťte, zda buňky obsahují mnoho, středně nebo málo volutinu. Volutinová zrna se barví purpurově. Téma: Barvení buněčných organel a struktur Úkol č. 1: Barvení pouzder Materiál: Podložní sklo, klička, pipety, mikroskop, pinzety, filtrační papír, Kongo červeň, roztok Maneval´s. Kultury: 24 hod. kultury Enterobacter aerogenes, E. coli, Proteus vulgaris Postup práce: 1. Na konec podložního sklíčka umístíme kapku Kongo červeně. 2. Kličkou přeneseme inokulum a rozmícháme. 3. Hranou dalšího podložního skla rozetřeme kapku do tenkého filmu po celé ploše podložního skla. 4. Nátěr necháme zaschnout na vzduchu (nefixujeme teplem). 5. Nátěr převrstvíme Maneval´s roztokem, necháme působit 1 min. 6. Opláchneme tekoucí vodou a osušíme. 7. Mikroskopujeme za použití imerze. Hodnocení výsledků: Vegetativní buňky jsou zbarveny modře (červeně) Pouzdra vytvářejí bílé prstence kolem buněk. Zakreslete pozorovaná pouzdra. Srovnejte vzájemně všechny kmeny. V závěru objasněte, proč jsou kapsuly špatně barvitelné. Z jakých látek jsou tvořeny, jakou mají funkci? Kdy je buňky tvoří? Objasněte, zda přítomnost kapsul je významná z hlediska virulence kmene (stupně patogenity) a proč? Úkol č.2: Barvení spor Bakteriální spory se vyznačují velmi špatnou barvitelností. K jejich obarvení je proto nutné použít metod agresivního barvení založeného na barvení koncentrovanými barvivy za horka. Materiál: Podložní sklo, klička, pipety, mikroskop, pinzety, filtrační papír, malachitová zeleň, mafranin. Kultury: 24 hod. a 1 týdenní kultury Bacillus subtilis, Bacillus megaterium, Bacillus cereus. Postup práce: 1. Připravíme si nátěry z 24 hod. a z 1 týdenní kultury a bez fixace je usušíme. 2. Na nátěr umístíme filtrační papír a nakapeme na něj roztok malachitové zeleně. 3. Sklíčko opatrně zahříváme 10 minut až do odpařování barviva, ale barvivo nesmí vřít, přitom však barvivo průběžně doplňujeme. 4. Po skončení barvení filtrační papír odstraníme a preparát opláchneme tekoucí vodou. 5. Převrstvíme vodným roztokem safraninu a barvíme 30 sekund. 6. Znovu opláchneme a po zaschnutí pozorujeme imerzním objektivem. Hodnocení výsledků: Spory pozorujeme zbarvené zeleně, vegetativní buňky červeně. Zakreslíme mikroskopický obraz. Stanovte typ pozorovaných spor. Stanovte % sporulujících buněk v 10 zorných polích. Popište podrobně děje, jejichž sled je zachycen na obrázku. Jakou funkci má sporulace u bakterií? . Úkol č. 3: Barvení bičíku Materiál: Podložní a krycí sklo, klička, pipety, mikroskop, pinzety, barvící roztok. Kultury: Proteus vulgaris, Pseudomonas aeruginosa Postup práce: 1. Do kapky destilované vody na podložním sklíčku naočkujte kulturu a zhotovte suspenzi. 2. Přikryjte krycím sklíčkem. 3. Nechte 3-5 minut zaschnout, dokud se nevytvoří vzduchové bubliny pod krycím sklíčkem. 4. Pozorujte preparát pod fázovým kontrastem. 5. Přidejte kapku barvícího roztoku na hranu krycího sklíčka tak, aby barva difundovala pod krycí sklíčko. 6. Preparát pozorujte. Hodnocení výsledků: Pozorujte bičíky a zakreslete jejich tvar a umístění. Charakterizujte, jaký význam mají bičíky pro baktérie. Zamyslete se nad tím, zda se mohou pohybovat i mikroorganismy, které nemají bičíky. Složení roztoků a kultivačních médií: Desoxycholát-citrát-laktóza agar (g/l) Bakteriologický pepton Masový extrakt Citrát sodný Thiosulfát sodný Citrát železitý Desoxycholát sodný Laktóza Neutrální červeň Agar Konečné pH = 7,5 +/- 0,2 při 25 ºC 5,0 5,0 6,0 5,4 1,0 3,0 10,0 0,02 12,0 MacConkey agar (g/l) Bakteriologický pepton Laktóza Žlučové soli Chlorid sodný Neutrální červeň Krystalová violeť Agar Konečné pH = 7,1 +/- 0,2 při 25 ºC 20,0 10,0 1,5 5,0 0,03 0,001 15,0 Columbia krevní agar (g/l) Speciální směs peptonů Škrob Chlorid sodný Agar Beraní krev Konečné pH = 7,3 +/- 0,2 při 25 ºC 23,0 1,0 5,0 12,0 50 ml Endo agar (g/l) Peptony Hydrogenfosforečnan draselný Laktóza Siřičitan sodný Bazický fuchsin Agar Konečné pH = 7,5 +/- 0,2 při 25 ºC 10,0 3,5 10,0 3,3 0,3 12,5 Slanetzův -Bartleyho agar (g/l) Tryptosa Kvasničný extrakt Glukosa Hydrogenfosforečnan draselný Azid sodný Trifenyltetrazoliumchlorid Agar Konečné pH = 7,2 +/- 0,2 při 25 ºC 20,0 5,0 2,0 4,0 0,4 0,1 10,0 Methylenová modř (barvení volutinu) 1% vodný roztok methylenové modři 100,0 ml alkohol 96% 20,0 ml K2CO3 1,0 g Směs volně zahříváme na vodní lázni (až se odpaří na 100 ml), ochladíme a přefiltrujeme. Methylenová modř - 10x zředěná (test vitality) nasycený alkoholový roztok methylenové modři 10,0 ml destilovaná voda 90,0 ml Nasycený alkoholový roztok připravíme rozpuštěním 2g barviva ve 100 ml 96% etanolu. Lugolův roztok jód 1,0 g jodid draselný 2,0 g destilovaná voda 10,0 ml Po rozpuštění doplníme objem destilovanou vodou na 300 ml. Kongo červeň Kongo červeň destilovaná voda 2,0 ml 100,0 ml roztok Maneval´s fenol (5% vodný roztok) ledová kyselina octová (20% vodný roztok) chlorid železitý (30% vodný roztok) kyselý fuchsin (1% vodný roztok) 30,0 ml 10,0 ml 4,0 ml 2,0 ml roztok Safraninu Safranin destilovaná voda 0,5 g 100,0 ml Malachitová zeleň Malachitová zeleň destilovaná voda 5,0 g 100,0 ml Rozlišení jedno a dvouřetězcové DNA pomocí AC voltametrie a odstranění interference zinečnatých iontů pomocí AdTSV Princip metody AC voltametrie (ACV) patří mezi voltametrické metody se střídavou složkou potenciálu. U této metody se na elektrodu vkládá lineárně se měnící potenciálová rampa. Na ni je superponováno střídavé napětí sinusového průběhu o malé amplitudě (10 mV) a nízké frekvenci (desítky až stovky Hz). Měří se závislost střídavého proudu procházejícího elektrodou na jejím potenciálu. DNA poskytuje v ACV řadu signálů. Některé z nich jsou citlivé ke změnám struktury DNA. Dvouřetězcová (ds) a jednořetězcová (ss) DNA poskytují pík 1, který je způsoben adsorpcí/desorpcí cukrfosfátové kostry. Ds DNA dále poskytuje pík 2 v důsledku adsorpce/desorpce zdeformovaných ds úseků. Ss DNA poskytuje pík 3, který je způsoben adsorpcí/desorpcí zbytků bází v jednořetězcových úsecích. Rozdílů v ACV záznamech lze využít pro rychlé rozlišení ss a ds DNA. Adsorptivní rozpouštěcí voltametrie je založena na užití adsorptivního nahromadění analytu z roztoku na povrchu pracovní elektrody. Naadsorbovaný analyt je pak v dalším kroku – voltametrickém scanu – rozpuštěn zpět do roztoku základního elektrolytu. Tím se o několik řádů zvýší detekční limit. Při adsorptivní přenosové rozpouštěcí voltametrii je analyt nahromaděn na povrchu elektrody (analyt se musí adsorbovat ireverzibilně) z malé kapky vzorku (3-5 µl), poté je elektroda s naadsorbovanou vrstvou omyta a přenesena do roztoku základního elektrolytu. Zde pak probíhá samotné elektrochemické měření. Díky aplikaci této metody se sníží potřebný objem vzorku o tři řády (jednotky ml – jednotky µl). Navíc lze tímto způsobem analyzovat vzorky DNA obsahující nízkomolekulární látky, které by mohly rušit elektrochemické měření. Pracovní postup – A: nativní a denaturovaná DNA - Denaturace DNA. DNA rozpuštěná ve vodě o koncentraci maximálně 150 µg/ml se zahřeje na 6 minut na 99 oC a poté se rychle ochladí v nádobě s ledem. - Připravená denaturovaná DNA i původní nativní DNA se naředí 0,2 M NaCl na koncentraci 30 µg/ml (připravovaný objem 30 µl) - Měření AC voltametrie – do měřící nádobky nalijeme 3 – 5 ml základního elektrolytu (roztok 0,3 M NaCl a 50 mM Na2HPO4 ze zásobních roztoků 3M NaCl a 0,5 M Na2HPO4). Provedeme voltametrické měření v potenciálovám rozsahu -0,6 až -1,6 V. Jako pracovní elektrodu používáme visící rtuťovou kapku. Měříme nejdříve základní elektrolyt a potom postupně oba vzorky DNA. Měření DNA probíhá pomocí adsorptivní přenosové rozpouštěcí voltametrie (AdTSV). Pracovní postup – B: interference zinku při AdSV a AdTSV - Do nádobky si připravíme základní elektrolyt (0,3 M NaCl a 50 mM Na2HPO4) - Do el.chem nádobky napipetujte ss DNA tak, aby výsledná koncentrace dosáhla 30 ug/ml - Změřte AC-voltametrii s 0 s a 30 s časem akumulace - Do el.chem nádobky přidejte roztok ZnSO4 tak, aby výsledná koncentrace byla 1mM - Změřte AC-voltametrii - Připravte si čistý základní elektrolyt - Nechte v původním roztoku (DNA+Zn) 30 s akumulovat DNA a změřte ACvoltametrii po přenosu do druhé nádobky v čistém ZE Materiál a pomůcky - potenciostat (Autolab) - elektrodový systém (663 VA-stand) - tlaková láhev s argonem - pufr 0,3 M NaCl, 50 mM Na2HPO4 - roztok 0,2 M NaCl - DNA Analýza nukleotidových sekvencí pomocí hybridizace se sondou značenou enzymem magnetických kuliček a Princip úlohy: Přítomnost určité sekvence nukleotidů v cílové DNA lze dokázat pomocí vhodně navržené sondy - krátkého úseku DNA, která s hledanou sekvencí hybridizuje, tj. vytvoří duplex DNA. Vznik duplexu detekujeme. V této práci bude cílová DNA s (dA)30-koncem nejprve navázána na magnetické kuličky modifikované (dT)25 řetězci. Bude-li v této DNA úsek komplementární k navržené sondě nesoucí biotin, dojde k hybridizaci. Na biotin bude poté navázán konjugát streptavidinu s enzymem, alkalickou fosfatázou, která přemění elektroneaktivní substrát 1-naftylfosfát na 1naftol, jehož oxidace bude detekována pomocí lineární voltametrie. Postup: 1) napipetujeme 40 µl kuliček DB-(dT)25 do eppendorfky, pomocí magnetu odebereme skladovací pufr a 3x promyjeme 100 µl 0,3M NaCl/ 10mM TRIS (tj. resuspendujeme na vortexu a pomocí magnetu odebereme promývací roztok a přidáme čistý) 2) před posledním odebráním promývacího pufru kuličky rozdělíme do 2 eppendorfek po 50 µl 3) do jedné eppendorfky napipetujeme 20 µl cílové DNA I (5 µg/ml) v roztoku 0,3M NaCl, do druhé totéž ale s cílovou DNA II 4) necháme inkubovat v termomixeru 12 min, 20 °C, 900 rpm 5) 3x promyjeme 100 µl 0,3M NaCl/ 10mM TRIS 6) do obou eppendorfek napipetujeme 20 µl biotinylované sondy (5 µg/ml) 7) viz 4) 8) viz 5) 9) přidáme 50 µl mléka (2,5 g sušeného mléka + 50 ml PBS) - necháme inkubovat 10 min, 20 °C, 900 rpm 10) po odebrání mléka přidáme 50 µl konjugátu streptavidinu s alkalickou fosfatázou 100x ředěného v mléce 11) viz 4) 12) promyjeme - 3x 100 µl PBST (fosfátový pufr + 0,2 % TWEEN) a 3x 100 µl 0,3M NaCl/ 10mM TRIS 13) přidáme 50 µl 100mM 1-naftylfosfátu v uhličitanovém pufru 14) viz 4) 15) odebereme roztok od kuliček a přeneseme ho do 1 ml uhličitanového pufru Elektrochemická detekce: metoda: LSV - lineární voltametrie pracovní elektroda: PGE - elektroda z pyrolytického grafitu roztok připravený v bodě 15) přeneseme do elektrochemické měřící nádobky, vložíme do ní elektrody, spustíme měření, vyhodnotíme Značení DNA komplexy oxidu osmičelého Komplexy oxidu osmičelého s bidentátními dusíkatými ligandy poskytují s pyrimidinovými zbytky bází v DNA kovalentní adukty. Thymin je asi 10x reaktivnější než cytosin. Pokud je jako ligand použit 2,2’-bipyridin (Os,bipy) je tato reakce specifická pouze pro jednořetězcovou DNA. Tato vlastnost byla použita pro detekci některých sekundárních struktur DNA. Tyto adukty jsou elektroaktivní a na rtuťových a uhlíkových elektrodách poskytují celou řadu elektrochemických signálů. Na rtuťových a uhlíkových elektrodách jsou to faradaické signály způsobené postupnou redukcí nebo oxidací atomu osmia v molekule aduktu. Pouze na rtuťových elektrodách pak lze získat signál katalytického vylučování vodíku v důsledku přítomnosti aduktu na povrchu pracovní elektrody. Tento katalytický signál může sloužit pro velmi citlivé stanovení modifikované DNA. Naproti tomu elektrodu z pyrolytického grafitu lze použít pro přímou analýzu reakční směsi, kdy je nezreagovaný komplex separován z povrchu pracovní elektrody extrakcí organickým rozpouštědlem (chloroform, isopropylalkohol). Pracovní postup: 1) Odpipetujte 20 µl CT-DNA (120 µg/ml) a nechte 10 min inkubovat při 95 stupních, prudce zchlaďte v ledové lázni 2) Připravte si 10 µl komplexu OsO4 s bipyridinem (20 mM ekvimolární) 3) Napipetujte: a) 2 µl komplexu, 5 µl ssDNA, 2 µl Tris-Cl pH 8, 11 µl H20 b) 2 µl komplexu, 5 µl dsDNA, 2 µl Tris-Cl pH 8, 11 µl H20 4) Obě zkumavky nechte inkubovat 30 min při 37 ˚C, sledujte čas 5) Připravte si analogickým způsobem dvě zkumavky s nemodifikovanou DNA (ss a ds) o koncentraci 30 µg/ml 6) Připravte si základní elektrolyt – 200 mM acetát sodný pH 5 7) Na uhlíkové elektrodě změřte signál ssDNA a dsDNA 8) Na uhlíkové elektrodě změřte signál DNA modifikované osmiem Elektrochemické měření: Do měřící nádobky napipetujeme 2 ml základního elektrolytu (0,2 M acetátový pufr, pH 5) provedeme záznam SWV s počátečním potenciálem -1, konečným potenciálem +1,5 V, frekvence 200 Hz amplituda 50 mV. Poté obnovíme povrch pracovní elektrody lepící páskou, naneseme vzorek (7 µl) a 60 s akumulujeme. Pak elektrodu opláchneme v destilované vodě, ethanolu a isopropylalkoholu (60 s). Po omytí provedeme měření. Po naměření provedeme elektrochemickou úpravu povrchu elektrody (30 s 1,8 V) a opět obnovíme povrch lepící páskou. Seznam potřebného vybavení a chemikálií: potenciostat (PalmSens) elektrodový systém (663 VA-stand), pracovní elektroda: PGE, referentní elektroda: Ag/AgCl/3M KCl, pomocná elektroda: platinový drát termomixér 0,2 M acetátový pufr, pH 5 roztok OsO4 roztok 2,2’-bipyridinu isopropylalkohol, ethanol Izolace plasmidové DNA Izolace plasmidové DNA pomocí kolonek od firmy QIAGEN Princip: V současné době je izolace plasmidové DNA velice usnadněna díky dostupnosti komerčních kitů, které umožňují zkrátit dobu nutnou pro izolaci, vyhnout se práci s některými chemikáliemi (fenol, chloroform) a získat plasmidovou DNA v požadované kvalitě. Na našem trhu jsou k dispozici izolační kity od několika firem (Qiagen, Macherey-Nagel, Sigma), které fungují na podobném principu a liší se pouze v detailech. K dostání jsou kolony o různé kapacitě, kolony, kterými nanesený lyzát protéká pouze za pomoci gravitační síly nebo kolony, u nichž je průtok lyzátu urychlen centrifugací. Posledně jmenované kolony zkracují čas potřebný pro izolaci, používají se hlavně při přípravě malých množství DNA, protože jejich kapacita je omezená. Poslední novinkou na trhu jsou kolony vybavené speciálním filtrem, které umožňují oddělit rozpustnou frakci lyzátu od nerozpustné bez použití centrifugace. A B Obr. 5.1: (A) Znázornění kolony od firmy Qiagen a její upevnění ve zkumavce. (B) Aniontové výměnné kolony firmy Qiagen o kapacitě 20-10 000 µg. Podstatou izolace DNA je alkalická lýze a oddělení nerozpustné buněčné frakce s chromozomální DNA od vodné frakce, ve které je rozpuštěna plasmidová DNA. Vodná frakce je nanesena na kolonu, jejíž náplň je tvořena chemicky upravenou pryskyřicí a při pH 7 obsahuje kladně nabité konce tvořené dietylaminoetanolem (DEAE). Kladné náboje interagují se záporně nabitými nukleovými kyselinami (obr. 5.2A) a zadrží je na koloně. Z kolony jsou nežádoucí biomakromolekuly vymyty pufrem, který obsahuje dostatečnou koncentraci solí pro uvolnění krátkých oligomerů, tRNA, rRNA a ssDNA, zatímco plasmidová DNA zůstane navázána. Eluce DNA je provedena pufrem o vyšší iontové síle než je promývací pufr (obr. 5.2B) A B Obr. 5.2: (A) Interakce DEAE se záporně nabitými fosfátovými skupinami DNA. (B) Separace jednotlivých druhů nukleových kyselin při neutrálním pH na aniontové výměnné koloně Pro úspěšnou izolaci čisté plasmidové DNA je kritickým krokem lýze buněk. Pokud lýzi buněk provedeme příliš drasticky, ať už prodloužením času nebo příliš intenzivním protřepáním směsi po přidání lyzačního pufru, fragmenty chromozomální DNA se uvolní do rozpustné frakce a v dalších krocích se při izolaci chová jako plasmidová DNA. Přečištění takto znehodnocené DNA je možné pouze za použití centrifugace v gradientu chloridu cesného, nicméně musíme počítat s nižším výtěžkem, protože chromozomální DNA na koloně kompetuje o vazebná místa s plasmidovou DNA. Pracovní postup: Tab.: Objemy bakteriální kultury a pufrů pro izolaci plasmidové DNA na aniontových výměnných kolonách Qiagen podle kapacity použité kolony. Kapacita kolony (µg) Objem kultury (l) Objem pufru P1 (ml) Objem pufru P2 (ml) Objem pufru P3 (ml) Objem pufru QBT (ml) Objem pufru QC (ml) Objem pufru QF (ml) Objem isopropanolu (ml) Objem etanolu (ml) Mini (20) 0,003 0,3 0,3 0,3 1 2x2 0,8 0,56 1 Midi (100) 0,025 (0,1) 4 4 4 4 2 x 10 5 3,5 2 Maxi (500) 0,1 (0,5) 10 10 10 10 2 x 30 15 10,5 5 Mega (2 500) 0,5 (2 ,5 ) 50 50 50 35 2 x 100 35 24,5 7 Giga (10 000) 2,5 (5 ) 125 125 125 75 2 x 300 75 52,5 10 Pozn. : Optimální objem kultury pro jednotlivé izolace je uveden pro plasmidy, které v bakteriálních buňkách vytvářejí velký počet kopií (řádově stovky až tisíce) nebo pro plasmidy nízkým počtem kopií (10-20) jejichž počet byl zvýšen amplifikací v důsledku kultivace v přítomnosti chloramfenikolu. V závorce je uveden objem bakteriální kultury pro plasmidy s nízkým počtem kopií, které nebyly amplifikovány. 1. Dobře rostlou a centrifugovanou bakteriální kulturu suspendujeme v pufru P1 tak, aby bakterie byly kompletně rozsuspendovány a nevytvářely žádné shluky. 2. Přidáme pufr P2, jemně ale důkladně zamícháme několikanásobným (4-6 x) obrácením zkumavky dnem vzhůru a inkubujeme 5 minut při pokojové teplotě. 3. Přidáme vychlazený pufr P3, jemně zamícháme (bod 2) a necháme inkubovat 15 minut v ledové lázni. 4. Centrifugujeme 30 minut při 4°C a RCF minimálně 20 000 x g. Supernatant, obsahující plasmidovou DNA, slejeme přes složenou gázu do připravené zkumavky. Odebereme 250 µl vyčištěného lyzátového supernatantu a uchováme pro nanesení na analytický gel (kontrolní vzorek 1). 5. Během centrifugace ekvilibrujeme kolonu QIAGEN-tip ekvilibračním pufrem QBT. Necháme kolonu vyprázdnit působením gravitace. 6. Na ekvilibrovanou kolonu naneseme supernatant (krok 4) a počkáme, než se kolona působením gravitace vyprázdní. Odebereme 250 µl vzorku prošlého kolonou a uchováme pro nanesení na analytický gel (kontrolní vzorek 2). 7. Promyjeme kolonu promývacím pufrem QC. Tímto krokem se zbavíme všech nečistot, jejichž vazba vůči kationtům v náplni kolony je slabší než vazba dsDNA (proteiny, RNA, ssDNA) Odebereme po 500 µl z promývacích frakcí a uchováme pro nanesení na analytický gel (kontrolní vzorky 3 a 4). 8. Eluujeme DNA elučním pufrem QF. Odebereme 100 µl eluátu a uchováme pro nanesení na analytický gel (kontrolní vzorek 5). 9. Získanou plasmidovou DNA vysrážíme přidáním isopropanolu (0,7 objemu). Zamícháme a okamžitě centrifugujeme 30 minut při ≥ 15 000 x g a teplotě 4°C. Opatrně slijeme supernatant. 10. Vysráženou DNA promyjeme 70% etanolem a centrifugujeme 10 minut při ≥ 15 000 x g a teplotě 4°C. Opatrně slijeme supernatant, abychom neporušili pelet. 11. Pelet vysušíme při sníženém tlaku po dobu 5-10 minut a DNA rozpustíme v TE pufru, pH 8.0. 12. Kontrolní vzorky 1-5 přesrážíme přidáním 0.7 objemu isopropanolu, centrifugujeme, promyjeme 80% etanolem a vysušíme. Rozpustíme v 50 µl TE pufru, pH 8.0. Na gel nanášíme po 10 µl přesrážených kontrolních vzorků. Tento krok provádíme souběžně se srážením izolované DNA. Během srážení si také připravíme 1% agarosový gel (krok 14). 13. Stanovení výtěžku a čistoty DNA provedeme UV spektrofotometrií při 260 a 280 nm a kvantitativní analýzou na agarosovém gelu. 14. Do Erlenmayerovy baňky navážíme 1 g agarosy, přidáme 100 ml 1 x TAE pufru, zamícháme a v mikrovlnné troubě vaříme 3 minuty při 500 W. Protože během varu dochází k odpaření vody, poznačíme si původní úroveň hladiny. Destilovanou vodou doplníme úbytek vody. Pod tekoucí vodou zchladíme agarosu na cca 60°C a naléváme na připravený nosič. Po ztuhnutí agarosy zalijeme gel 1 x TAE pufrem (400-500 ml), ke vzorkům (10 µl ) přidáme 2 µl 6 x koncentrovaného nanášecího pufru a vzorky naneseme na gel. 15. Elektroforézu provádíme při 80 V po dobu 60 minut. Gel vyjmeme z aparatury, vložíme do roztoku ethidiumbromidu (1 µg/ml) necháme 15 minut barvit. Poté gel vyjmeme a zobrazíme pod UV světlem. POZOR!!! S roztokem ethidiumbromidu a gely, které jsou jím obarveny manipulujeme zásadně v rukavicích!! ! 16. Z intenzity zbarvení standardů a izolované DNA stanovíme výtěžek izolace. 17. Změřením absorbance při 260 nm a 280 nm provedeme nezávislé stanovení výtěžku DNA a její čistoty. Dvoušroubovicová DNA o koncentraci 50 µg/ml dává v kyvetě o tloušťce 1 cm hodnotu absorbance při 260 nm 1. Poměr absorbancí při 260 a 280 nm by měl činit minimálně 1.8. 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 Obr. 5.3: Kontroly izolace plasmidů pBSK(dráhy 1,5,9,13), pPGM1 (2,6,10,14), pPGM2 (3,7,11,15) a pPGM3 (4,8,12,16). V drahách 1-4 jsou kontroly buněčného lyzátu před nanesením na aniontovou výměnnou kolonu (kontroly 1), dráhy 5-8 představují kontroly 2 – lyzát prošlý kolonou, dráhy 9-12 představují spojené frakce kontrolních vzorků 3 a 4 – promývací frakce, v drahách 13-16 jsou vzorky eluované z kolony. Izolace plasmidové DNA pomocí centrifugačních kolonek Princip: Pro izolaci plasmidové DNA je možné použít nejen kolonky, u kterých je k přečištění a uvolnění zachycené plasmidové DNA využíváno přirozené gravitační pole. Na trhu jsou k dispozici izolační kity, které využívají odstředivou sílu vznikají při centrifugami. Princip izolace je obdobný jako v případě gravitačních kolonek. Použití vyššího přetížení nám však umožňuje zkrátit čas potřebný pro izolaci na 20-30min. Na druhé straně centrifugační kolonky mají nižší kapacitu, izolací proto získáme menší množství DNA. Pracovní postup: 1. V centrifuze stočíme 1-5 ml bakteriální kultury kultivované v LB médiu. Centrifugami provádíme 30 sekund při 11 000 x g. Odstraníme supernatant, pokud možno kompletně. 2. Přidáme 250 µl pufru A1. Resuspendujeme buněčný pelet na vortexu. Pro účinnou izolaci je nutné, aby v suspenzi nezůstaly viditelné shluky buněk. Přidáme 250 µl pufru A2. Promícháme přvrácením zkumavky dnem vzhůru a zpět 68x. Nevortexujeme! Inkubujeme při pokojové teplotě 5 min. Přidáme 300 ml pufru A3. Opět jemně zamícháme převrácením zkumavky (6-8x). Nevortexujeme! 3. Centrifugujeme 5 – 10 min při 11 000 x g při pokojové teplotě. 4. Vložíme NucleoSpin®Plasmid kolonu do 2 ml sběrné zkumavky a naneseme supernatant z bodu 3 na kolonu. Centrifugujeme 1 min při 11 000 x g. Odstraníme proteklý roztok. 5. Vložíme NucleoSpin®Plasmid kolonu zpět do sběrné zkumavky a přidáme 600 µl pufru A4. Centrifugujeme 1 min při 11 000 x g. Roztok prošlý kolonou odstraníme. 6. Abychom dostatečně vysušili membránu, na které je plasmidová DNA navázána, vložíme NucleoSpin®Plasmid kolonu zpět do prázdné sběrné zkumavky a centrifugujeme další 2 min při 11 000 x g. Tento krok zabezpečí odstranění zbytků etanolu, který je součástí promývacího pufru A4. Etanol může inhibovat enzymatické reakce, ke kterým může být izolovaná DNA použita. 7. Vložíme NucleoSpin®Plasmid kolonu do 1,5 ml mikrocentrifugační zkumavky a přidáme 50 µl pufru AE. Inkubujeme 1 min při pokojové teplotě. Centrifugujeme 1 min při 11 000 x g. Opakováním tohoto kroku můžeme dosáhnout zvýšení výtěžku o 15-20%. Eluce může být prováděna destilovanou vodou nebo TE pufrem. Kontrola čistoty a koncentrace izolované DNA Po izolaci DNA (plasmidové, chromozomální) je nutné zjistit její koncentraci a čistotu. Pro další aplikace izolovaných DNA je naprosto nezbytné zajistit, aby do reakcí (sekvenování, PCR apod.) bylo bráno alespoň přibližně stejné množství DNA. Rovněž izolované vzorky nesmějí být kontaminovány jinými molekulami, např. proteiny nebo látkami typu fenolů. Ke stanovení čistoty a druhu nukleové kyseliny ve vzorku se používá výpočet poměru hodnot absorbancí při 260 a 280nm. Nukleové kyseliny mají absorpční maximum při 260 nm, absorpční maximum proteinů a aromatických látek je kolem 280 nm. Pro přesné stanovení čistoty a koncentrace je třeba vzít v úvahu možný vliv pufrů s vysokou absorbancí, zákal vzorku, či použití kyvet se zúženou štěrbinou. Protože ani nukleové kyseliny ani proteiny neabsorbují při 320 nm, používá se tato vlnová délka pro kompenzaci vlivu absorbance pozadí. Index čistoty DNA je dán poměrem absorbancí při 260 a 280 nm, sníženým o rozptyl světla při 320 nm. Čistá DNA má tento poměr minimálně 1,8; čistá RNA 2,0. Hodnoty významně nižší signalizují přítomnost nečistot ve vzorku a nutnost dalšího přečištění. Také zvýšená absorbance při 230 nm může být způsobena nečistotami. Vlnová délka 230 nm je blízká absorpčnímu maximu peptidových vazeb, také Tris, EDTA a jiné pufry absorbují při této vlnové délce. Absorbance 260nm se používá pro kvantifikaci čistých nukleových kyselin: roztok s absorbancí 1,0 v kyvetě s optickou dráhou 10 mm odpovídá koncentraci 50 µg/ml u dvouřetězcové DNA, 40 µg/ml u ssDNA a RNA, a 33 µg/ml u oligonukleotidů (může se měnit v zavislosti na složení bází). U vzorků s příměsí proteinů lze přibližnou koncentraci vypočítat dle Warburgovy-Christianovy rovnice: Cprotein = (1552,0 *A280) – (757,3*A260) Cnukleová kys. = (62,9 *A260) – (36,0*A280) Štěpení plasmidové DNA restrikčními endonukleázami, sestavení restrikční mapy Princip: Prudký rozvoj metod molekulární biologie přímo souvisí s objevem restrikčních endonukleáz, které umožňují sekvenčně specifickou fragmentaci DNA. Restrikční endonukleázy jsou součástí tzv. restrikčně modifikačních mechanismů bakterií. Tento systém je zajišťován dvěma druhy enzymových aktivit – metylační a restrikční. Enzymy s metylační aktivitou specificky modifikují (metylují) vlastní buněčnou DNA, čímž ji chrání před degradací restrikčními enzymy. Restrikční endonukleázy jsou bakteriemi využívány ke štěpení cizorodé DNA, která není v příslušných sekvencích metylována. Pro účely klonování v molekulární biologii se proto zpravidla používají buňky zbavené restrikční aktivity. Restrikční endonukleázy rozpoznávají krátké sekvence dvouřetězcové DNA a štěpí ji ve specifických místech nebo poblíž nich. Jsou známy tři typy restrikčních endonukleáz. Typy I. a III. třídy vykazují zároveň modifikační i ATP–dependentní restrikční aktivitu. Enzymy skupiny I. se vážou na specifickou rozpoznávací sekvenci, ale štěpí DNA v nedefinované oblasti mimo rozpoznávanou sekvenci. Enzymy této skupiny nemají praktické využití při genových manipulacích. Uplatnění nenašly ani enzymy III. skupiny, neboť ke štěpení DNA dochází opět mimo rozpoznávací oblast. Nejvhodnější pro využití v molekulární biologii jsou enzymy II. skupiny, které nevyžadují ATP, jsou striktně specifické a rozpoznávají tzv. palindromové sekvence, tj. dvouvláknové úseky DNA, které mají v obou vláknech opačně orientovanou sekvenci bází. Délka těchto rozpoznávacích sekvencí se pohybuje nejčastěji mezi 4 – 6 páry bází, existují ale restrikční endonukleázy rozpoznávající sekvence o 15 párech bází. Tento parametr je rozhodující pro četnost, se kterou enzym bude štěpit molekulu DNA. Volbou restrikční endonukleázy lze tedy ovlivnit délku vznikajících úseků. Enzymy II. skupiny lze dále rozdělit podle způsobu, jakým DNA štěpí, na tři podskupiny: a/ poskytující jednovláknové úseky na 5‘ koncích EcoRI 5‘.........GAATTC.............3 3‘.........CTTAAG.............5‘ 5‘.....G3‘ 3‘.....CTTAA5‘ 5‘AATTC.......3‘ 3‘G.......5‘ b/ poskytující jednovláknové úseky na 3‘ koncích PvuI 5‘.........CGATCG.............3 5‘.....CGAT3‘ 3‘.........GCTAGC.............5‘ 3‘.....GC5‘ 5‘CG.......3‘ 3‘TAGC.......5‘ c/ poskytující tupé konce StuI 5‘.........AGGCCT.............3‘ 5‘.....AGC3‘ 5‘CCT.......3‘ 3‘.........TCCGGA.............5‘ 3‘.....TCC5‘ 3‘GGA.......5‘ Materiál a chemikálie: - Plasmidová DNA - Restrikční endonukleázy + pufry - 96% a 80% etanol (-20°C) - 3 M octan sodný pH 5,0 - Hlubokomrazící box –80°C - Stolní centrifuga - Pipety, špičky - Rukavice - Mikrozkumavky 1,5 ml - Vortex - Aparatura pro agarosový gel - Agarosa - Termostat na 37°C - Elektroforetický pufr (TAE, TBE) - Zdroj napětí - Ethidiumbromid (1 µg/ml) - Dokumentační systém Pracovní postup: 1) Připravíme si sadu označených mikrozkumavek. Do nich podle pokynů vedoucího cvičení napipetujeme vzorky jedné z variant uvedených v tabulce. Při přípravě vzorků pipetujeme podle následujícího schématu DNA, pufr, destilovanou vodu a restrikční endonukleázu, v případě dvojnásobných štěpení první enzym. DNA (1 µg) 4-5 µl pufr (10 x koncentrovaný) 2 µl restrikční endonukleáza (2-3 U) 1 µl destilovaná voda do 20 µl Vzorky zamícháme a vložíme do termostatu na 37°C. Necháme inkubovat 30 minut Číslo vzorku 1 2 3 skupina 4 5 6 Použité restrikční endonukleázy A EcoRI ScaI BglI EcoRI + ScaI EcoRI + BglI ScaI + BglI B BamHI XmnI PvuII BamHI + XmnI BamHI + PvuII XmnI + PvuII C EcoRI SmaI AvaII EcoRI + SmaI EcoRI + AvaII SmaI + AvaII D HindIII ScaI RsaI HindIII + ScaI HindIII + RsaI ScaI + RsaI . 2) Ke vzorkům přidáme 2 µl 3 M octanu sodného, pH 5.0, zamícháme a přidáme 70 µl vychlazeného 96% etanolu. Zamícháme a necháme 10 minut při -80°C. 3) Vzorky centrifugujeme při 14 000 x g po dobu 10 minut. Slijeme supernatant a k peletu DNA přidáme 500 µl vychlazeného (-20°C) 80% etanolu. Zamícháme a centrifugujeme 10 minut při 14 000 x g. Odebereme supernatant a zkumavky s vysráženou a promytou plastidovou DNA vložíme do exsikátoru a sušíme 5-10 za sníženého tlaku. 4) Vysušenou DNA rozpustíme v 17 µl destilované vody, přidáme pufr pro druhou restriktázu (2 µl), restrikční endonukleázu (2-3 U, tj. 1 µl) a necháme inkubovat při 37°C po dobu 30 minut. (U vzorků štěpených pouze jedním enzymem rozpustíme DNA ve 20 µl TE pufru, pH 8.0. Vzorky necháme při laboratorní teplotě do doby než je společně s ostatními vzorky naneseme na agarosový gel.) 5) Během inkubace si připravíme 100 ml 1% agarosový gel v 1 x TAE pufru (100 ml) a 500 ml 1 x TAE pufru. 6) Ke vzorkům přidáme 4 µl 6 x koncentrovaného nanášecího pufru a nanášíme na agarosový gel. 7) Elektroforézu provádíme při 80 V po dobu 60 minut. Gel vyjmeme z aparatury, vložíme do roztoku ethidiumbromidu (1 µg/ml) a necháme 15 minut barvit. Poté gel vyjmeme a zobrazíme pod UV světlem. POZOR!!! S roztokem ethidiumbromidu a gely, které jsou jím obarveny manipulujeme zásadně v rukavicích!!! 8) Na gelu porovnáme mobilitu jednotlivých fragmentů s velikostí fragmentů markerové DNA a odhadneme velikost fragmentů získaných restrikčním štěpením. Z počtu získaných fragmentů zjistíme, kolik rozpoznávacích míst pro jednotlivé restrikční endonukleázy plasmidová DNA obsahuje, a pokusíme se určit jejich vzájemnou polohu. Výsledkem je restrikční mapa plasmidové molekuly DNA. 9) Výsledky porovnáme s teoretickými hodnotami, získanými ze známých restrikčních míst v plasmidu pBluescript II SK(-) a jeho délky (2961 pb): a. AvaII 2184, 2406 b. BamHI 719 c. BglI 466, 2160 d. EcoRI 701 e. HindIII 689 f. PvuII 529, 977 g. RsaI 654, 2525 h. ScaI 2526 i. SmaI 713 j. XmnI 2645 Současné štěpení DNA dvěma nebo více restriktázami Princip: Při štěpení DNA restrikčními endonukleázami lze v některých případech použít více restriktáz současně. Tento postup šetří čas a také odpadá riziko ztráty DNA při nedokonalém přesrážení vzorku. Při zvažování, zda můžeme štěpit zároveň více restriktázami, je nezbytné porovnat prostředí, v nichž jsou dané restriktázy aktivní. Jako každé enzymy, i restrikční endonukleázy vyžadují pro svou aktivitu optimální pH, přítomnost iontů (obvykle Mg2+) a iontovou sílu. Většina restrikčních endonukleáz má optimální teplotu štěpení 37°C, ale najdou se i takové, u nichž je optimální teplota nižší (30°C) nebo naopak vyšší (50-65°C) Všechny tyto parametry musíme důkladně prozkoumat než se rozhodneme pro současné štěpení. BglI: 50 mM Tris-HCl (pH 7,5 při 37°C), 10 mM MgCl2, 100 mM NaCl, 0,1 mg/ml BSA; 37°C. EcoRI: 50 mM Tris-HCl (pH 7,5 při 37°C), 10 mM MgCl2, 100 mM NaCl, 0,02% Triton X100, 0,1 mg/ml BSA; 37°C. ScaI: 50 mM Tris-HCl (pH 7,5 při 37°C), 10 mM MgCl2, 100 mM NaCl, 1 mM DTT; 37°C. Porovnáním reakčních pufrů dospějeme k závěru, že u uvedených enzymmů lze provést současné štěpení. Pro jednotlivé kombinace jsme vybrali: EcoRI + ScaI: pufr pro ScaI ScaI + BglI: pufr pro ScaI BglI + EcoRI: pufr pro BglI Při rozhodování, který z pufrů vybrat hraje roli stabilita enzymu, jeho cena. Užitečným vodítkem při volbě pufru jsou tabulky v katalozích firem dodávajících enzymy. Z tabulek lze vyčíst, které kombinace restriktáz jsou možné a jaký pufr je pro danou kombinaci vhodný. Pracovní postup: 1) Připravíme si sadu označených mikrozkumavek. Do nich podle níže uvedené tabulky napipetujeme DNA, vhodný pufr a uvedenou kombinaci restrikčních endonukleáz. Vzorky zamícháme a vložíme do termostatu na 37°C. Necháme inkubovat 60 minut Číslo vzorku (RE) 1 - 2 EcoRI 3 ScaI 4 BglI 5 EcoRI + ScaI 6 ScaI + BglI 7 EcoRI + BglI DNA 1 1 1 1 1 1 1 Pufr E 2 2 - - - - - Pufr S - - 2 - 2 2 - Pufr B - - - 2 - - 2 EcoRI - 5 - - 5 - 5 ScaI - - 5 - 5 5 - BglI - - - 5 - 5 5 H 2O 17 12 12 12 7 7 7 . 2) Během inkubace si připravíme 100 ml 1% agarosový gel v 1 x TAE pufru a 500 ml 1 x TAE pufru 3) Ke vzorkům přidáme 4 µl 6 x koncentrovaného nanášecího pufru a nanášíme na agarosový gel. 4) Elektroforézu provádíme při 80 V po dobu 60 minut. Gel vyjmeme z aparatury, vložíme do roztoku ethidiumbromidu (1 µg/ml) a necháme 15 minut barvit. Poté gel vyjmeme a zobrazíme pod UV světlem. POZOR!!! S roztokem ethidiumbromidu a gely, které jsou jím obarveny manipulujeme zásadně v rukavicích!!! 5) Na gelu porovnáme mobilitu jednotlivých fragmentů s velikostí fragmentů markerové DNA a odhadneme velikost fragmentů získaných restrikčním štěpením. Z počtu získaných fragmentů zjistíme, kolik rozpoznávacích míst pro jednotlivé restrikční endonukleázy plasmidová DNA obsahuje, a pokusíme se určit jejich vzájemnou polohu. Výsledkem je restrikční mapa plasmidové molekuly DNA. 6) Výsledky porovnáme s teoretickými hodnotami, získanými ze známých restrikčních míst v plasmidu pBluescript II SK(-) a jeho délky (2961 pb): a. BglI b. EcoRI c. ScaI 466, 2160 701 2526 Obr.: Mapa plasmidu pBluscript II SK(-), který byl použit pro přípravu plasmidů řady pPGM vložením vazebné sekvence pro protein p53 do HindIII místa. 1 2 3 4 5 6 7 8 Obr.: Výsledek štěpení plasmidu pB II SK (-) restrikčními endonukleázami. 1. 2. 3. 4. 5. 6. 7. 8. scDNA; 2961 pb pBS/EcoRI; lin. 2961 pBS/ScaI; lin. 2961 pBS/BglI; lin. 1267 a 1694 pb (2160 – 466 = 1694; 2961 – 1694 = 1267) pBS/(EcoRI + ScaI); lin. 1136 a 1825 pb (2526 – 701 = 1825; 2961 – 1825 = 1136) pBS/(BglI + ScaI); lin. 366, 901 a 1694 pb (2526 – 2160 = 366; 2160 – 466 = 1694; 2961 – 1694 – 366 = 901) pBS/(BglI + EcoRI); lin. 235, 1267 a 1459 pb (701 – 466 = 235; 2160 – 701 = 1459; 2961 – 235 – 1459 = 1267) Standardy: (odspodu nahoru) 250, 500, 750, 1000, 1500, 2000, 2500, 3000, 3500, 4000, 5000, 6000, 8000, 10000 pb. Interakce DNA-protein Princip: Genetická informace je v buňkách uložena v DNA, k replikaci DNA a expresi genů je kromě DNA zapotřebí molekul, jejichž funkce spočívá v realizaci těchto pochodů na základě informace obsažených v DNA. Jde o proteiny, které se vážou na DNA a následně se účastní, replikace, přepisu jednotlivých genů, odbourávání nukleových kyselin, oprav poškozených úseků. Svou vazbou aktivují nebo deaktivují specifické oblasti DNA pro fungování v buněčném metabolismu, účastní se regulace buněčného cyklu apod. Abychom byli schopni porozumět účasti a roli specifických proteinů v buněčných procesech, je nezbytné poznat a pochopit mechanismy interakce těchto proteinů s nukleovými kyselinami. Účelem prováděných experimentů je identifikovat sekvenci a strukturu oblastí DNA, ke kterým se daný protein váže, specifikovat vazebné domény proteinu, pomocí nichž dochází k vazbě na DNA, poznat podmínky in vitro a in situ, které jsou vyžadovány pro vznik účinné vazby. Kromě jiných způsobů můžeme interakci DNA-protein zkoumat pomocí gelové elektroforézy nebo tzv. „footprintingu“. V prvním případě do reakční směsi k testované DNA přidáme zkoumaný protein, necháme inkubovat a na agarosovém nebo polyakrylamidovém gelu zjišťujeme, zda se mezi použitou DNA a proteinem vytvořila dostatečně pevná vazba. Interakce se projeví snížením elektroforetické mobility komplexu DNA-protein ve srovnání s mobilitou samotné DNA. Jde tedy o detekci interakce na úrovni celé molekuly DNA, význam této metody spočívá v testování, zda použitá DNA obsahuje sekvenci nebo strukturu nezbytnou pro vazbu proteinu, můžeme ji použít ke stanovení ostatních faktorů nezbytných pro vazbu proteinu na DNA, např. pH, iontová síla, přítomnost nebo absence specifických iontů, oxidačně-redukční stav proteinu, specifické modifikace aminokyselin v proteinu, vazba mutantních proteinů apod. Protein p53, který působí jako nádorový supresor, s DNA interaguje několika odlišnými způsoby. Nejdůkladněji prozkoumána je tzv. sekvenčně-specifická vazba, při které se p53 váže na tzv. konsensní sekvenci: 5´-RRRC(A/T)(A/T)GYYY(N)0-13 RRRC(A/T)(A/T)GYYY-3´ Vazba na tuto sekvenci je pro p53 charakteristická při jeho působení v roli transkripčního faktoru. Na lineární DNA bez konsensní sekvence se p53 váže také, ale tato vazba je mnohem slabší a má náhodný charakter. Kromě těchto dvou vazeb byla popsána i vazba na scDNA. Tato vazba je také sekvenčně nespecifická, nevyžaduje přítomnost konsensní sekvence, na rozdíl od vazby na lineární DNA je mnohem silnější. Její biologický význam není zcela jasný. 1 2 3 4 5 6 7 8 Obr. 1: Agarosový gel ukazující vazbu proteinu p53 na specifickou sekvenci DNA (p53CON) při různých teplotách. Plasmid pPGM1 obsahující specifickou vazebnou sekvenci pro protein p53 byl štěpen restrikční endonukleázou PvuII. Výsledkem štěpení jsou dva fragmenty o délkách 474 a 2513 bp. Specifická vazebná sekvence se nachází v kratším fragmentu. Po přidání proteinu p53 k DNA se vazba projeví snížením elektroforetické pohyblivosti kratšího fragmentu a výskytem nového proužku na gelu (R „band“), který odpovídá komplexu DNA-p53. Plasmid pBS na rozdíl od plasmidu pPGM1 neobsahuje p53CON, proto nevytváří sekvenčně specifickou vazbu s p53. To se na gelu projeví tím, že plasmid pBS štěpený PvuII neposkytne R „band“. Tvorba komplexu mezi proteinem p53 a delším fragmentem je zřetelná při nižších teplotách, v tomto případě jde o sekvenčně-nespecifickou vazbu, protože delší fragment žádnou specifickou sekvenci pro p53 neobsahuje. Tato sekvenčně-nespecifická vazba je mnohem méně stabilní.V dráze 1 je kontrola - DNA bez proteinu p53, dráhy 24 zobrazují vazbu proteinu p53 na DNA při teplotách 0°C (dráha 2); 26°C (3); 37°C (4); 42°C (5); 44°C (6); 46°C (7) a 48°C (8). Materiál a chemikálie: - DNA - Protein p53 - Vazebný pufr (5 mM Tris-HCl pH 8,0, 0,01% Triton X-100) - 1 M KCl - Ledová lázeň - Agarosa - 0,33 x TBE - Elektroforetická aparatura - Zdroj napětí - Mikrozkumavky, špičky, pipety Pracovní postup: vazba proteinu p53 na lineární DNA 1. Do zkumavek napipetujeme podle tabulky DNA, 1 µl 10 x koncentrovaného vazebného pufru, 1 M KCl a protein p53. Vodou doplníme na objem 10 µl. číslo vzorku 1 2 3 4 5 6 7 8 9 10 0,5 0,5 0,5 - - - - - - - pPGM1/PvuII (200 µg/ml) sc pBS - - - 0,5 0,5 0,5 - - - - - - - - - - 2 2 2 - vazebný pufr (10 x cc) 1 1 1 1 1 1 1 1 1 1 0,5 0,5 0,5 0,5 0,5 0,5 0,5 0,5 0,5 0,5 p53 - 0,3 0,5 - 0,3 0,5 - 0,3 0,5 0,5 H 2O 8 7,7 7,5 8 7,7 7,5 6,5 6,2 6 8 pBS/PvuII (200 µg/ml) 1 M KCl 2. 3. 4. 5. Vzorky necháme 20 minut inkubovat v ledové lázni. Připravíme 1,2% agarosový gel v 0,33 x TBE pufru. Ke vzorkům přidáme 2 µl 6 x koncentrovaného nanášecího pufru a naneseme na gel. Gelovou elektroforesu provádíme ve vychlazeném pufru. Podmínky elektroforézy: 0,33 x TBE, 4°C, 120 V, 2 hodiny. 6. Po skončení elektroforézy gel obarvíme v roztoku EtBr o koncentraci 1 µg/ml, vymyjeme EtBr nenavázaný na DNA a zobrazíme pod UV světlem. 7. Výsledky zaznamenáme a uložíme v dokumentačním systému. Vyhodnotíme, u kterých vzorků došlo k tvorbě sekvenčně-specifické vazby a jak se projevila. 8. Po vyfocení gel použijeme pro vakuový proteinový přenos na nitrocelulosovou membránu. Separace proteinů vertikální elektroforézou Princip: Gelová elektroforéza je velmi účinná metoda pro dělení biomakromolekul – nukleových kyselin a proteinů. Dělení proteinů probíhá v polyakrylamidovém gelu ve vertikálním uspořádání. Vhodnou volbou koncentrace gelu zajistíme účinné dělení proteinů v požadovaném rozmezí molekulových hmotností. Proteiny o vysoké molekulové hmotnosti dělíme v řidším gelu (5%), menší proteiny a peptidy v koncentrovanějším polyakrylamidu (20%). Ve srovnání s nukleovými kyselinami jsou proteiny mnohem rozmanitější jak tvarem, tak i celkovým nábojem, který se může měnit i při poměrně malých změnách pH. To vše ovlivňuje mobilitu proteinů. Výsledná mobilita proteinů při elektroforéze je dána jejich molekulovou hmotností a „hustotou náboje“ (poměr velikosti elektrického náboje k molekulové hmotnosti). Na rozdíl od nukleových kyselin, u nichž je „hustota náboje“ konstantní (každý nukleotid obsahuje zbytek kyseliny fosforečné), u proteinů je elektrický náboj veličina, která nijak nezávisí na jejich molekulové hmotnosti. Abychom mohli výsledky polyakrylamidové gelové elektroforézy proteinů snáze interpretovat, využíváme její modifikace, tzv. denaturační SDS-PAGE. Při této variantě elektroforézy analyzované proteiny před nanesením na gel denaturujeme pomocí dodecylsulfátu (dodecylsíranu, laurylsíranu) sodného a β-merkaptoetanolu. Účinek βmerkaptoetanolu spočívá v eliminaci případných disulfidových vazeb, takže se rozpadnou proteinové komplexy složené z více řetězců. Dodecylsulfát sodný obklopí molekulu proteinu a v důsledku elektrostatického odpuzování dojde k denaturaci proteinů. Protože dodecylsulfát sodný se váže na proteiny přímo úměrně k jejich molekulové hmotnosti, původní náboj proteinu je překryt a výsledkem je vytvoření molekul s konstantní hustotou náboje bez ohledu na velikost molekul. Denaturace je dokončena krátkým varem těsně před nanesením vzorků na gel. U takto připravených proteinů je eliminován náboj a původní tvar a jediným faktorem, který bude určovat mobilitu proteinů v polyakrylamidovém gelu, bude velikost molekuly (molekulová hmotnost). Obr. 1: Ukázka efektivního rozdělení proteinů v polyakrylamidových gelech lišících se koncentrací akrylamidu a elektroforetickým pufrem. Zeleně je zobrazeno dělení v kontinuálním systému (bez zaostřovacího gelu), modře dělení při použití diskontinuálního provedení (se zaostřovacím gelem). Koncentrace gelu je uvedena v záhlaví jednotlivých drah. Zdroj: katalog firmy Bio-Rad Materiál a chemikálie: - Zásobní roztok pro přípravu separačního gelu: (10% akrylamid:bisakrylamid 19:1; 0,375 M Tris-HCl, pH 8,8; 0,1% SDS) - Zásobní roztok pro přípravu zaostřovacího gelu: (2,5% akrylamid:bisakrylamid 19:1; 0,125 M Tris-HCl, pH 6,8; 0,1% SDS) - 10% persíran amonný (APS) - TEMED (N,N,N´,N´-tetrametyletylendiamin) - Elektrodový pufr: 25 mM Tris; 0,192 M glycin; 0,1% SDS, pH 8,3 - Izolovaný protein - Proteinové standardy - Proteinové vzorky: mléko, sušené mléko, syrovátka, kasein, lysozym, BSA, p53 - 2 x CSB: 50 mM Tris-HCl, pH 6,8; 100 mM β-merkaptoetanol; 2% SDS; 0,1% bromfenolová modř; 10% glycerol - Roztok Coomassie Briliant Blue R-250: 0,25% Coomassie Briliant Blue R-250; 45% (v/v) metanol; 10% (v/v) kyselina octová - Odbarvovací roztok: 25% (v/v) metanol; 10% (v/v) kyselina octová - Pipety - Špičky - Mikrozkumavky - Vodní lázeň - Elektroforetická aparatura - Zdroj napětí - Třepačka - Dokumentační systém Pracovní postup: Obr. 2: Součásti a skládání aparatury pro polyakrylamidovou vertikální elektroforézu proteinů Mini-PROTEAN Tetra cell. a) Příprava polyakrylamidového gelu: 1) Destilovanou vodou a etanolem důkladně očistíme a poté vysušíme skla elektroforetické aparatury. Skla se „spacery“ přiložíme k sobě a sestavíme aparaturu. Obr. 3: Skládání sestavy pro nalévání gelu 2) K 10 ml zásobního roztoku 10% akrylamidu pro separační gel (10% akrylamid:bisakrylamid 19:1; 0,375 M Tris-HCl, pH 8,8; 0,1% SDS) přidáme 100 µl 10% persíranu amonného a 10 µl TEMEDu. Směs opatrně zamícháme a naléváme do formy vymezené skly. Polymerizační směs naléváme asi 2-2,5 cm pod úroveň nižšího skla. Povrch opatrně převrstvíme slabou vrstvou butanolu (20-30 µl) – vyrovná případné nerovnosti. Necháme 10-15 min polymerovat. Jako kontrolu pro správnou polymeraci použijeme zbytky polymerační směsi. 3) Po ztuhnutí separačního gelu odsajeme vrstvu butanolu a na separační gel naneseme 2,5% zaostřovací gel (připravíme přidáním 40 µl 10% persíranu amonného a 15 µl TEMEDu ke 4 ml zásobního roztoku zaostřovacího gelu), vložíme hřeben a necháme polymerovat. V tabulce jsou uvedeny poměry jednotlivých složek pro přípravu gelů o různých koncentracích. 4) Poté, co zaostřovací gel zpolymeruje (zkontrolujeme opět podle polymerizace nepoužitých zbytků směsi v kádince), opatrně vyjmeme hřeben a starty promyjeme elektrodovým pufrem, abychom se zbavili zbytků nezpolymerovaného akrylamidu. 5) Gel se skly vložíme do aparatury a zalijeme elektrodovým pufrem (25 mM Tris; 192 mM glycin; 0,1% SDS, pH 8,3). Obr. 4: Postup při sestavování aparatury Tab.: Rozpis pro přípravu SDS-PAGE se zaostřovacím a separačním gelem. Zásobní roztok Akrylamidbisakrylamid (29:1) Zásobní pufr pro zaostřovací gel Zásobní pufr pro separační gel Zásobní elektrodový pufr (10 x konc.) Zaostřovací gel Finální koncentrace akrylamidu v separačním gelu (%) 5,0 7,5 10,0 12,5 15,0 17,5 20,0 Elektrodový pufr 2,5 5,0 7,5 10,0 12,5 15,0 17,5 20,0 - 5,0 - - - - - - - - - 3,75 3,75 3,75 3,75 3,75 3,75 3,75 - - - - - - - - - 100 10% SDS 0,2 0,3 0,3 0,3 0,3 0,3 0,3 0,3 - 10% APS 0,15 0,25 0,25 0,25 0,25 0,25 0,25 0,25 - voda 12,15 20,7 18,2 15,7 13,2 10,7 8,2 5,7 900 TEMED 0,015 0,015 0,015 0,015 0,015 0,015 0,015 0,015 - Hodnoty jsou udány v ml a jsou vypočteny pro přípravu 20 ml zaostřovacího gelu, 30 ml separačního gelu a 1000 ml elektrodového pufru. Finální koncentrace pufrů: v zaostřovacím gelu: 0,125 M Tris-HCl, pH 6,8 v separačním gelu: 0,375 M Tris-HCl, pH 8,8 elektrodový pufr: 0,025 M Tris, 0,192 M glycin, pH 8,3 b) Příprava vzorků: 1) Do 1,5 ml zkumavek navážíme přibližně 10 mg proteinů. Vzorky rozpustíme v pufru tak, aby jejich koncentrace byla 10 mg/ml. (Navážíme sušené mléko, syrovátku, kasein, BSA, lysozym. Ke stanovení bílkovin v polotučném mléku odebereme 50 µl mléka. Protein p53 naředíme 10 x ze zásobního roztoku.) 2) Do čistých zkumavek přeneseme 50 µl vzorků a přidáme 50 µl 2 x CSB. 3) Směs povaříme na vodní lázni po dobu 3-5 min. 4) Do jednotlivých startů na gelu nanášíme vzorky podle tabulky. Číslo vzorku 1 2 3 4 5 6 7 8 9 10 protein mléko sušené mléko syrovátka kasein BSA lysozym p53 p53 p53 p53 10 10 10 10 10 10 5 10 15 20 Objem (µl) c) Elektroforéza: 1) Elektroforetickou aparaturu s nanesenými vzorky uzavřeme víkem s konektory a připojíme na zdroj napětí. 2) Doporučené parametry pro separaci bílkovin jsou uvedeny v následující tabulce: Čas [min] 15 15 60 Elektrické napětí [V] 50 100 150 Poznámka pro zakoncentrování vzorku indikační barva opouští koncentrační gel indikační barva na kraji separačního gelu Uvedené časy jsou pouze orientační, které se musí přizpůsobit daným podmínkám analýzy (závisí např. na koncentraci gelu) a na průběh separace je nutno dohlížet. Indikační barva nesmí přesáhnout spodní okraj separačního gelu. 3) Vypneme zdroj, vyjmeme gel a opatrně oddělíme skla. Na gelu odřízneme pravý horní roh – tímto označíme orientaci gelu a zabráníme záměně levé strany za pravou. d) Barvení gelu a dokumentace: 1) Gel vložíme do roztoku Coomassie Briliant Blue R-250 a za mírného třepání necháme barvit asi 20 min. 2) Barvící roztok slijeme zpět do láhve (opatrně, abychom se nepotřísnili – barvící schopnosti jsou značné a skvrny na rukou nebo oděvu lze odstranit velmi obtížně) a gel přelijeme odbarvovacím roztokem. Za mírného třepání při laboratorní teplotě necháme gel odbarvovat. 3) Po zmodrání odbarvovacího roztoku jej vyměníme a necháme třepat do úplného vymizení modrého pozadí – podle potřeby několikrát vyměníme odbarvovací roztok. 4) Gel zdokumentujeme. 1 2 3 4 5 6 7 8 9 Obr. 5: Polyakrylamidová gelová elektroforéza proteinů. 1. kasein (5 mg/ml); 5 µl 2. kasein (5 mg/ml); 10 µl 3. sušené mléko (5 mg/ml); 5 µl 4. sušené mléko (5 mg/ml); 10 µl 5. – 6. – 7. syrovátka (5 mg/ml); 5 µl 8. syrovátka (5 mg/ml); 10 µl 9. p53; 5 µl (pod detekčním limitem) 10. p53; 10 µl (pod detekčním limitem) 10 Přenos biomakromolekul na membránu (blotting) Princip: Při izolaci a separaci biomakromolekul gelovou elektroforézou často stojíme před problémem, který ze změti fragmentů nukleových kyselin obsahuje hledanou sekvenci nebo v kterém proužku se ukrývá konkrétní protein. Tyto potíže jsou způsobeny nespecifickým značením elektroforeticky rozdělených molekul nukleových kyselin nebo proteinů v gelu. Řešení představuje přenos (blotting) biomakromolekul na membránu, na které jsou specifickými metodami identifikovány hledané molekuly. Podle toho, který typ makromolekuly přenášíme, rozeznáváme: - Southernův přenos: jde o přenos DNA; - northernový přenos: z gelu na membránu jsou přenášeny ribonukleové kyseliny; - westernový přenos neboli přenos proteinů. Dalším kritériem pro dělení metody může být způsob, kterým je makromolekula na membránu přenášena. Potom mluvíme o: - elektroforetickém přenosu, u kterého je využito elektrického pole; - vakuovém přenosu: gel je položen na membránu, která je umístěna na porézní podložce, a přelit pufrem. Pufr je nasáván pumpou a vzniklý podtlak společně s pufrem zprostředkují přenos; - kapilárním přenosu: je využito kapilárních sil, které prostupují gelem a membránou a strhávají s sebou nukleové kyseliny nebo proteiny. Vzlínání pufru je zajištěno navrstvením savého materiálu na membránu. Po přenesení biomakromolekul na membránu je identifikace provedena specifickými metodami, které se liší podle toho, o jaký typ biomakromolekul se jedná: u nukleových kyselin vyhledáváme zkoumanou sekvenci zpravidla pomocí hybridizační sondy, u proteinů často využíváme imunochemických metod. Vakuový přenos biomakromolekul na membránu Obr.: Aparatura pro vakuový přenos proteinů nebo nukleových kyselin z gelu na membránu Materiál a chemikálie: - Gel s přenášeným proteinem - Blotovací aparatura - Filtrační papír - Nitrocelulosová membrána - Rukavice - Přenosový pufr (10 x SSC: 87,65 g NaCl, 44,1 g citrátu sodného v 1000 ml roztoku; pH 7,0) Pracovní postup: 1. Sestavíme blotovací aparaturu: Na porézní podložku do prostoru vymezeného otvorem v igelitu umístíme 3-4 vrstvy filtračního papíru navlhčeného přenášecím pufrem (10 x SSC), na filtrační papíry položíme nitrocelulosovou membránu zastřiženou na rozměry odpovídající rozměrům gelu. Vždy po položení jednotlivých vrstev pečlivě skleněnou pipetou nebo tyčinkou odstraníme případné bubliny, které by mohly narušit přenos. Orientaci membrány označíme zastřižením pravého horního rohu. Na membránu položíme gel v odpovídající orientaci tak, aby jeho kraje přečnívaly přes otvor v igelitové masce. Pečlivě zkontrolujeme a odstraníme případné netěsnosti. 2. Gel zalijeme blotovacím pufrem a zapneme vakuovou pumpu. Na manometru nastavíme požadovaný podtlak. Přenos probíhá asi 1,5 hodiny. Během této doby kontrolujeme průběh přenosu, zda nedošlo k narušení vakua, v případě, že byl vyčerpán veškerý blotovací pufr, nalijeme na gel ze zásobního roztoku. 3. Po skončení přenosu zrušíme vakuum, z blotovací aparatury vyjmeme membránu a imunochemicky detekujeme proteiny. Elektroforetický přenos biomakromolekul na membránu („elektroblotting“) Při tomto způsobu přenosu je využito elektrického pole. Používá se pro přenos biomakromolekul z polyakrylamidových gelů. Pro přenos z agarózových gelů není vhodny, protože se vlivem elektrického pole vyvíjí značné množství tepla, v důsledku čehož by při nedostatečném chlazení mohlo dojít k roztavení agarózového gelu. Obr.: Aparatura pro elektroforetický přenos biomakromolekul na membránu Materiál a chemikálie: - Gel s přenášeným proteinem - Aparatura pro elektroforetický přenos - Filtrační papír - Nitrocelulosová membrána - Rukavice - Přenosový pufr (25 mM Tris, pH 8,3, 192 mM glycin, 0,1% SDS) Pracovní postup: 1. Ustřihneme membránu a filtrační papír podle velikosti gelu. Při práci s membránou pracujeme zásadně v rukavicích, abychom se vyvarovali případné kontaminace membrány. Zastřižením jednoho rohu membrány si označíme orientaci gelu. 2. Gel, membránu, filtrační papíry a vláknité podložky ekvilibrujeme 15 minut v přenosovém pufru. 3. Jednotlivé části „sendvičové“ sestavy uspořádáme v kazetě následujícím způsobem: a. Kazetu umístíme na čistý povrch, šedou deskou dolů. b. Vložíme navlhčenou vláknitou podložku na šedou stranu kazety. c. Na vláknitou podložku položíme zvlhčený filtrační papír. d. Na filtrační papír dáme ekvilibrovaný gel, na který ve zvolené orientaci umístíme připravenou membránu. e. Sestavu zkompletujeme položením navlhčeného filtračního papíru na membránu a následným vložením vláknité podložky. f. Kazetu uzavřeme přiklopením průhledné desky a sepnutím obou desek klipsnou (viz. obr.) Pozn.: Jednotlivé vrstvy musí k sobě těsně přiléhat, případné bubliny se negativně projeví na účinnosti přenosu. Bubliny mezi vrstvami odstraníme rolováním skleněnou tyčinkou. 4. Uzavřenou kazetu s gelem a membránou umístíme do elektrodové jednotky. 5. Elektrodovou jednotku vložíme do rezervoáru pufru. Při vkládání dbáme správné orientace vzhledem ke směru elektrického pole. (Pro studenty se slabšími znalostmi fyzikálních procesů – dodržovat barevné značení na aparatuře: červená k červené a černá k černé). 6. Přidáme chladicí blok vymražený na -20°C a rezervoár zcela naplníme vychlazeným přenosovým pufrem. 7. Do rezervoáru vložíme magnetické míchadélko a aparaturu postavíme na el.-mag. plotnu. Rychlost míchání nastavíme tak, aby vyvíjející se teplo a migrující ionty byly rovnoměrně distribuovány. 8. Aparaturu uzavřeme nasazením víka s kably a připojíme ke zdroji napětí. Na zdroji nastavíme limitní parametry pro přenos na 30 V a 90 mA. Nastavením limitů zajistíme, že během přenosu nedojde k přehřátí aparatury. Přenos necháme probíhat přes noc. 9. Po ukončení přenosu rozebereme blotovací „sendvičovou“ sestavu a proteiny na membráně detekujeme pomocí protilátek. „Dot blot“ („slot blot“) Uvedené termíny slouží k označení postupů, při kterých nejsou biomakromolekuly přenášeny za použití některé z výše zmíněných technik z gelu na membránu, ale jsou na membránu jednoduše naneseny pomocí mikropipety. Nanesené vzorky se do membrány vsáknou ve tvaru teček (dot) nebo čárek (slot). Tato technika se používá např. při analýze frakcí získaných chromatografickou separací pro zjištění, ve kterých frakcích je hledaný protein přítomen nebo jako zkušební test pro zjištění, jaká koncentrace izolovaného proteinu či jaké ředění primární nebo sekundární protilátky jsou vhodné k dostatečně citlivé imunodetekci. Detekce naneseného proteinu probíhá stejně jako u vzorků přenesených na membránu z gelu. Materiál a chemikálie: - Nitrocelulosová membrána - Protein p53 - Pipety - Špičky, mikrozkumavky - Rukavice - Pufr na ředění proteinu p53 (10 mM Tris-HCl, 1 mM EDTA, pH 8) Pracovní postup: 1. Ze zásobního roztoku proteinu p53 připravíme postupným ředěním koncentrační řadu vzorků tak, abychom měli protein 1 x (původní koncentrace), 10 x, 100 x a 1000 x zžeděný. 2. Na nitrocelulosovou membránu naneseme mikropipetou po 0,5 µl připravených vzorků ve formě kapek. Nanesené vzorky necháme vsáknout a zaschnout. 3. Detekci naneseného proteinu provádíme stejným způsobem jako u vzorků přenesených na membránu z gelu (viz. protokol „Imunochemická detekce proteinů“). Imunochemická detekce proteinů Princip: Detekci proteinů provádíme často imunochemickými metodami. O něco delší procedura ve srovnání s klasickým barvením proteinů např. Coomassie Briliant Blue R-250 nebo stříbrem je vykoupena vyšší citlivostí a možností detekovat konkrétní bílkovinu pomocí specifické protilátky ve směsi proteinů. Po přenosu na membránu následuje vysycení volných vazebných míst na membráně albuminem nebo mléčnými bílkovinami. Potom membránu inkubujeme v roztoku, který obsahuje protilátku proti hledanému proteinu. Tato tzv. primární protilátka je připravena tak, aby vykazovala silnou specifitu vůči sledovanému proteinu. V dalším kroku se použije sekundární protilátka konjugovaná s enzymem (alkalická fosfatáza, peroxidáza, luciferáza apod.). Sekundární protilátka je druhově specifická, to znamená, že rozeznává primární protilátku podle druhu organizmu, v kterém byla primární protilátka produkována. Pro úspěšnou detekci je nezbytné použít sekundární protilátku se specifitou odpovídající protilátce primární. Samotná detekce je založena na reakci enzymu konjugovaného se sekundární protilátkou. Do inkubační směsi je přidán specifický substrát zvolený tak, aby při jeho přeměně na produkt došlo k barevné reakci nebo emisi světelných kvant. Protože komplex protein-Ab1-Ab2-enzym je ukotven na membráně, k reakci dojde pouze v místech, kde je komplex navázán. Jeho pozice na membráně je indikována zbarvením membrány, případně pozitivním signálem na rentgenovém filmu. Z intenzity zbarvení můžeme odhadnout přibližné množství proteinu v daném místě. Imunochemická detekce proteinu p53 Materiál a chemikálie: - Nitrocelulosová membrána s přeneseným proteinem p53 - 1 x PBS (8 g NaCl, 0,2 g KCl, 1,44 g Na2HPO4, 0,24 g KH2PO4 v 1 000 ml roztoku) - 5% odtučněné mléko v 1 x PBS - Primární protilátka - Sekundární protilátka s konjugovaným detekčním enzymem (ALP) - 1 x PBST (8 g NaCl, 0,2 g KCl, 1,44 g Na2HPO4, 0,24 g KH2PO4, 0,5 ml Tween-20 v 1 000 ml roztoku) - Třepačka - Pufr pro ALP (100 mM Tris/HCl, 100 mM NaCl, 10 mM MgCl2, pH 9,8). - BCIP (5-bromo-4-chloro-3-indolylfosfát); 50 mg/ml ve 100% dimetylformamidu - NBT (nitrobluetetrazolium chlorid); 50 mg/ml v 70% dimetylformamidu - Pipety, špičky - Rukavice Pracovní postup: 1. Membránu s přeneseným proteinem inkubujeme 30 minut v 5% roztoku odtučněného mléka rozpuštěného v 1 x PBS. Inkubaci provádíme při pokojové teplotě za mírného třepání. Tímto krokem zablokujeme volná vazebná místa na membráně. 2. Do misky s membránou přidáme primární protilátku ředěnou v poměru 1:50 - 1:150. Inkubujeme 45 minut při pokojové teplotě za mírného třepání. Pozn.: V případě potřeby můžeme inkubaci provádět přes noc. V takovém případě se doporučuje misku s membránou a primární protilátkou vložit do chlazené místnosti s teplotou kolem 4°C. 3. Roztok s primární protilátkou vylijeme a membránu promyjeme 3 x po 5 minutách v roztoku 1 x PBST. 4. Přidáme sekundární protilátku konjugovanou s alkalickou fosfatázou (detekční enzym) v 5% roztoku mléka v 1 x PBS. Ředění sekundární protilátky záleží na množství detekovaného proteinu, pohybuje se v poměrech 1:1000 - 1:10 000. Inkubujeme 45 minut při pokojové teplotě. 5. Membránu promyjeme 3 x po 5 minutách v roztoku 1 x PBST. 6. Po promytí inkubujeme membránu v alkalickém pufru, nutném pro funkci alkalické fosfatázy (100 mM Tris/HCl, 100 mM NaCl, 10 mM MgCl2, pH 9,8). 7. Přidáme 5-bromo-4-chloro-3-indolylfosfát (BCIP) spolu s nitrobluetetrazolium chloridem (NBT). Na 10 ml inkubačního pufru přidáme 100 µl směsi BCIP a NBT získané smícháním zásobních roztoků v poměru 1:2. 8. Alkalická fosfatáza odštěpuje fosfátovou skupinu z BCIP, zbytek sloučeniny vytváří s NBT červenofialové zbarvení membrány v místě navázaného proteinu. A B 1 1 2 3 2 4 5 3 6 4 Obr.: Imunochemické stanovení proteinu p53. (A) elektroblot provedený po rozdělení proteinu p53 v polyakrylamidovém gelu. Starty obsahují postupně se zvyšující množství proteinu p53: (1) 2 µl; (2) 4 µl; (3) 6 µl; (4) 8 µl; (5) 10 µl; (6) 12 µl. (B) „Dot blot“ proteinu p53. Na membránu bylo naneseno po 0,5 µl neředěného (1); 10 x ředěného (2); 100 x ředěného (3) a 1000 x ředěného (4) proteinu p53. Příprava kompetentních buněk a transformace plasmidové DNA do bakterií Princip: V laboratoři často nastává situace, kdy je třeba rekombinantní DNA (většinou plasmid s ligovaným úsekem DNA) vpravit do bakteriálních buněk, kde se pomnoží. Bylo vypracováno několik technik, které se liší použitými pufry, způsobem přenosu DNA do buněk a v neposlední řadě i účinností. Nejčastěji používanou technikou je transformace. Ta vyžaduje tzv. kompetentní buňky (schopné přijmout cizorodou DNA), které se připravují inkubací bakteriálních buněk v přítomnosti např. vápenatých iontů při 0°C. Při tomto procesu se podstatně zvýší prostupnost buněčné stěny pro molekuly plasmidu. Po krátkém zahřátí na 42°C plasmidová DNA vstupuje do bakterií. Další metodou je elektroporace, při které je roztok, v němž jsou bakterie spolu s plasmidovou DNA, vystaven krátkému elektrickému impulsu o vysokém napětí. Impuls vytvoří v bakteriální stěně póry, kterými se DNA dostane dovnitř buněk. Materiál: - agarová plotna s narostlými koloniemi bakteriálního kmene, který chceme použít k transformaci - plasmidová DNA - 0,1 M CaCl2 - MgCl2-CaCl2 (80 mM MgCl2, 20 mM CaCl2) - LB médium (případně SOB) - SOC médium - agarové plotny s SOB médiem, 20 mM MgSO4, selekčním antibiotikem - centrifuga - sterilní polypropylenové kyvety 50 ml - sterilní mikrozkumavky - vodní lázeň 42°C - termostat 37°C - pipety - rukavice - sterilní špičky Pracovní postup: a) příprava kompetentních buněk kalciovou metodou 1) Z agarové plotny setřeme oddělenou, dobře narostlou kolonii a přeneseme ji do 100 ml LB média. Inkubujeme kulturu při 37°C do dobu 2-3 hodin za intenzivního třepání. Nádoba, ve které kultivace probíhá, má mít objem minimálně 5 x větší než je objem média. 2) Přelijeme bakteriální kulturu do sterilních vychlazených 50 ml polypropylenových zkumavek. Uložením kultury do ledové lázně na 10 minut ji vychladíme na 0°C. 3) Centrifugací při 4000 rpm při 4°C po dobu 10 minut shromáždíme bakteriální buňky na dně centrifugační kyvety. 4) Opatrně slijeme supernatant. Postavíme kyvety dnem vzhůru na filtrační papír nebo buničinu a necháme je v této poloze 1 minutu, abychom se zbavili posledních zbytků kultivačního média. 5) Bakterie v každé 50 ml kyvetě resuspendujeme jemným třepáním v 30 ml vychlazeného (0°C) roztoku MgCl2-CaCl2. 6) Zkumavky vložíme na 10 minut do ledové lázně. 7) Centrifugujeme při 4000 rpm, 4°C, po dobu 10 minut. 8) Slijeme supernatant z kyvet. Obrátíme zkumavky dnem vzhůru a postavíme je na filtrační papír nebo buničinu. V této poloze je necháme 1 minutu, aby vytekly zbytky supernatantu. 9) Pelet v každé kyvetě resuspendujeme ve 2 ml 0,1 M CaCl2 vychlazeného v ledové lázni. 10) Bakterie v CaCl2 rozdělíme po 50-200 µl do sterilních mikrozkumavek. Jednotlivé alikvoty můžeme použít přímo k transformaci nebo je můžeme zamrazit na –70°C. Pokud s buňkami nemůžeme pracovat ihned, můžeme je v tomto stadiu 1-2 dny uchovávat při 4°C. Účinnost transformace u těchto buněk během 12-24 hodin vzroste 4-6 x, potom se vrací na svou původní hodnotu. b) transformace bakterií plasmidovou DNA 1) K 200 µl kompetentních buněk ve vychlazeném 0,1 M CaCl2 přidáme DNA (maximálně 50 ng v objemu 10 µl nebo menším). Jemně zamícháme a inkubujeme 30 minut v ledu. 2) Přeneseme zkumavky do vodní lázně temperované na 42°C. Ponecháme je v lázni přesně 90 sekund. Pozn.: Teplotní šok je kritický krok celého postupu. Pro účinnou transformaci je třeba dodržet co možná přesně teplotu i čas. Při kratších časech je účinnost transformace snížená, při delších časech nastává odumírání bakterií. 3) Rychle přeneseme zkumavky zpět do ledové lázně na 1-2 minuty. 4) Do každé mikrozkumavky přidáme 800 µl SOB média. Vzorky inkubujeme 45 minut při 37°C, abychom bakteriím umožnili se vzpamatovat a obnovit svou bakteriální stěnu. 5) Na agarovou plotnu obsahující SOB médium s 20 mM MgCl2 a antibiotikem, proti němuž transformované bakterie získaly resistenci, vysejeme 100-200 µl buněčné suspenze. Kulturu pomocí sterilní, zahnuté skleněné tyčinky rovnoměrně rozetřeme po celém povrchu plotny. 6) Plotny ponecháme při pokojové teplotě, dokud není veškerá kapalina absorbována. 7) Obrátíme plotny dnem vzhůru a inkubujeme při 37°C. Kolonie transformovaných bakterií se objeví za 12-16 hodin. Pozn.: Jak příprava kompetentních buněk, tak transformace musí probíhat sterilním způsobem, aby nedošlo ke kontaminaci.
Podobné dokumenty
program kniha abstrakt - Institute of Experimental Botany AS CR
 elementům. Například až čtvrtina genů v bakteriálních genomech nemá dosud známou funkci. Dalším úkolem
genomiky je studium exprese jednotlivých genů, např. v chorobných stavech a při diferenciaci b...
elementům. Například až čtvrtina genů v bakteriálních genomech nemá dosud známou funkci. Dalším úkolem
genomiky je studium exprese jednotlivých genů, např. v chorobných stavech a při diferenciaci b...
Funkce proužků pro základní vyšetření moče
 z komplexu protony a pH na proužku se měří směsí tří indikátorů popsaných u měření pH. Při
nízké koncentraci iontů je zbarvení tmavomodré a se zvyšující koncentrací iontů se mění na
zelené až žluto...
z komplexu protony a pH na proužku se měří směsí tří indikátorů popsaných u měření pH. Při
nízké koncentraci iontů je zbarvení tmavomodré a se zvyšující koncentrací iontů se mění na
zelené až žluto...
Podrobné informace o poskytovaných vyšetřeních
 výsledkem (zřejmě v důsledku asymptomatické kolonizace dýchacích cest).
výsledkem (zřejmě v důsledku asymptomatické kolonizace dýchacích cest).
2010 - Moderní biofyzikální přístupy v experimentální biologii
 MODERNÍ BIOFYZIKÁLNÍ METODY:
POKROČILÉ PRAKTICKÉ VZDĚLÁVÁNÍ V EXPERIMENTÁLNÍ
BIOLOGII
Operační program Vzdělávání pro konkurenceschopnost
Číslo projektu: CZ.1.07/2.3.00/09.0046
MODERNÍ BIOFYZIKÁLNÍ METODY:
POKROČILÉ PRAKTICKÉ VZDĚLÁVÁNÍ V EXPERIMENTÁLNÍ
BIOLOGII
Operační program Vzdělávání pro konkurenceschopnost
Číslo projektu: CZ.1.07/2.3.00/09.0046
Sekvenování genomů
 • 2-3 kb (nebo kratší), kódují transposasu, cut & paste
nebo copy & paste v genomu bez přepisu do RNA
• 2-3 kb (nebo kratší), kódují transposasu, cut & paste
nebo copy & paste v genomu bez přepisu do RNA
2011 - Moderní biofyzikální přístupy v experimentální biologii
 MODERNÍ BIOFYZIKÁLNÍ METODY:
POKROČILÉ PRAKTICKÉ VZDĚLÁVÁNÍ V EXPERIMENTÁLNÍ
BIOLOGII
Operační program Vzdělávání pro konkurenceschopnost
Číslo projektu: CZ.1.07/2.3.00/09.0046
MODERNÍ BIOFYZIKÁLNÍ METODY:
POKROČILÉ PRAKTICKÉ VZDĚLÁVÁNÍ V EXPERIMENTÁLNÍ
BIOLOGII
Operační program Vzdělávání pro konkurenceschopnost
Číslo projektu: CZ.1.07/2.3.00/09.0046