Chemie 9, procvičování 21
Transkript
Názvům doplň vzorce, vzorcům názvy: fosforečnan hlinitý K2SO4 bromid hořečnatý PCl5 fosforečnan železitý CaCl2 síran lithný PbHPO4 chlorečnan draselný SiCl4 1. Kolik látky musíme rozpustit v 1000 g vody, aby vznikl 22% roztok? 2. Ve vodě o hmotnosti 790 g jsme rozpustili 50 g látky. Jakou koncentraci má roztok, který vznikl? 3. V jakém množství vody musíme rozpustit 80 g látky, aby vznikl 40% roztok? Názvům přiřaď vzorce, vzorcům názvy: oxid chromový MgO chlorid cíničitý HBO2 kyselina fosforitá SnO Pojmenuj reaktanty a produkty, rovnici vyčísli: KClO3 → KClO4 + KCl As + HNO3 + H2O → H3AsO4 +NO KMnO4 + HCl → Cl2 + MnCl2 + KCl + H2O Pojmenuj reaktanty a produkty, rovnici vyčísli: a) PbS + H2O2 → PbSO4 + H2O b) Ca3(PO4)2 + SiO2 → CaSiO3 + P2O5 c) P2O5 + C → CO + P d) Kolik látky musíme rozpustit ve 1300 g vody, aby vznikl 14% roztok? e) Ve vodě o hmotnosti 1010 g jsme rozpustili 140 g látky. Jakou koncentraci má roztok, který vznikl? f) V jakém množství vody musíme rozpustit 60 g látky, aby vznikl 10% roztok? Pojmenuj reaktanty a produkty, rovnice vyčísli: a) KCl + H2O → KOH + H2 + Cl2 b) KOH + CO2 → K2CO3 + H2O Pojmenuj reaktanty a produkty (v případě c doplň produkty), rovnice vyčísli: a) H3PO4 + Ca(OH)2 → Ca3(PO4)2 + H2O b) V2O5 + KOH → K3VO4 + H2O c) HCl + ZnO → …. + ….. d) Na2S + CaCO3 → Na2CO3 + CaS Pojmenuj reaktanty a produkty, rovnice vyčísli: a) SO2 + NO + H2O → H2SO4 + N2O b) C + HNO3 → CO2 + NO2 + H2O c) Cu2S + HNO3 → Cu(NO3)2 + H2SO4 + NO + H2O Pojmenuj reaktanty, doplň a pojmenuj produkty, rovnice vyčísli: 1. HNO3 + Cu(OH)2 → 2. Zn + HCl → 3. Fe + H2SO4 → 4. CuSO4 + Fe → 5. CuO + H2SO4 → 6. FeO + HI → 7. H2SO4 + NaOH → 8. HBr + CaO → Sestav rovnice, vyčísli: 1. Chlorid fosforitý reaguje s vodou za vzniku kyseliny trihydrogenfosforité a kyseliny chlorovodíkové 2. Oxid křemičitý eaguje s kyselinou fluorovodíkovou za vzniku *** a vody 3. Fosforečnan vápenatý (sůl kyseliny trihydrogenfosforečné) reaguje s kyselinou sírovou za vzniku síranu vápenatého a kyseliny trihydrogenfosforečné 4. Hydroxid sodný reaguje s kyselinou dusičnou za vzniku *** a ***. 5.Oxid siřičitý reaguje s hydroxidem sodným za vzniku siřičitanu sodného a vody. Pojmenuj reaktanty, doplň a pojmenuj produkty, rovnice vyčísli: a) Mg + H2SO4 → MgSO4 + H2 b) As2O3 + HNO3 + H2O → H3AsO4 + NO oxid wolframičitý HPO2 dusičnan měďnatý Bi(OH)3 kyselina fosforečná ZnO oxid chromový Na2CO3 síran manganitý AgNO2 oxid bismutitý HIO4 kyselina pentahydrogenantimoničná H3PO2 síran vápenatý CaSO3 chlorid sodný MnCl3 síran hlinitý Pb(OH)2 1. V jakém množství vody musíme rozpustit 110 g látky, aby vznikl 10% roztok? 2. Pojmenuj reaktanty a produkty, rovnici vyčísli: KClO3 + KI + H2SO4 → KCl + I2 + K2SO4 + H20 3. Kolik látky musíme rozpustit ve 630 g vody, aby vznikl 20% roztok? 4. Pojmenuj reaktanty a produkty, rovnici vyčísli: FeSO4 → Fe2O3 + SO3 + SO2 5. Vypočti kolik látky musíš rozpustit a v jakém množství vody, abys připravil 1310 g roztoku s koncentrací 18 %. 6. Pojmenuj reaktanty a produkty, rovnici vyčísli: MnO2 + NaClO + NaOH → NaMnO4 + NaCl + H2O 7. Ve vodě o hmotnosti 550 g jsme rozpustili 90 g látky. Jakou koncentraci má roztok, který vznikl? 8. Co je to elektrolýza? Vysvětli. 9. Pokud chceme elektrolyticky pokovit nějaký předmět, k jaké elektrodě ho připojíme? 10. Co je to vytěsňování?
Podobné dokumenty
Názvosloví anorganických sloučenin
 j) CoSO4 · 7H2O
k) Cu3 (AsO4)2 · 4H2O
l) NaClO · 5H2O
m) Zn (NO3)2 · 6H2O
n) ZnSO3 · 2H2O
o) (NH4)2CO3 · H2O
p) Cu (IO3)2 · H2O
q) Be (NO3)2 · 3H2O
r) Na3VO4 · 10H2O
s) Y (NO3)3 · 4H2O
Názvy
a) hex...
j) CoSO4 · 7H2O
k) Cu3 (AsO4)2 · 4H2O
l) NaClO · 5H2O
m) Zn (NO3)2 · 6H2O
n) ZnSO3 · 2H2O
o) (NH4)2CO3 · H2O
p) Cu (IO3)2 · H2O
q) Be (NO3)2 · 3H2O
r) Na3VO4 · 10H2O
s) Y (NO3)3 · 4H2O
Názvy
a) hex...
PL - VYČÍSLOVÁNÍ ROVNIC
 Pracovní list:
Vyčísli rovnice:
HgO → Hg + O2
S + O2 → SO2
C + O2 → CO2
Ca + O2 → CaO
Fe + 3 O2 → Fe2O3
Cu + O2 → CuO
H2 + Cl2 → HCl
Na + HCl → H2 + NaCl
Zn + HCl → ZnCl2 + H2
CuO + HCl → H2O + CuCl2
Pracovní list:
Vyčísli rovnice:
HgO → Hg + O2
S + O2 → SO2
C + O2 → CO2
Ca + O2 → CaO
Fe + 3 O2 → Fe2O3
Cu + O2 → CuO
H2 + Cl2 → HCl
Na + HCl → H2 + NaCl
Zn + HCl → ZnCl2 + H2
CuO + HCl → H2O + CuCl2
PDF verze
 Bi(OH)3
Bi2S3
CaCO3
CaCrO4
CaF2
CaHPO4
Ca(OH)2
Ca3(PO4)2
CaSO4
CaSO3
CdCO3
Cd(OH)2
CdS
CoCO3
Co(OH)2
Co(OH)3
CoS (α)
CoS (β)
Cr(OH)3
CuBr
CuCO3
CuCl
Bi(OH)3
Bi2S3
CaCO3
CaCrO4
CaF2
CaHPO4
Ca(OH)2
Ca3(PO4)2
CaSO4
CaSO3
CdCO3
Cd(OH)2
CdS
CoCO3
Co(OH)2
Co(OH)3
CoS (α)
CoS (β)
Cr(OH)3
CuBr
CuCO3
CuCl
PDF verze
 Disociační konstanty kyselin a zásad
pKa ( pKb ) – záporný dekadický logaritmus disociační konstanty kyseliny (zásady) při 25°C. U vícesytných kyselin (zásad) je stupeň disociace označen římskou čí...
Disociační konstanty kyselin a zásad
pKa ( pKb ) – záporný dekadický logaritmus disociační konstanty kyseliny (zásady) při 25°C. U vícesytných kyselin (zásad) je stupeň disociace označen římskou čí...
Tabulka 8
 log β1 = 3,4; log β2 = 7,2
2. Objem 100 ml 0,01 molárního roztoku Mg(NO3)2 byl titrován roztokem EDTA téže koncentrace.
log β1 = 3,4; log β2 = 7,2
2. Objem 100 ml 0,01 molárního roztoku Mg(NO3)2 byl titrován roztokem EDTA téže koncentrace.

 kyselina tetrahydrogenkřemičitá
kyselina tetrahydrogenkřemičitá
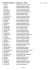 9. [Cu(NH3)4](ClO4)2
10. (NH4)2[SiF6]
11. [Cu(NH3)6]Br2
12. Rb[MnCl3]
13. K2[ReCl6]
14. Na2[Pb(OH)6]
15. K2[ZrF6]
16. [Ni(NH3)6]Br2
17. [Hg(NH3)2]Br2
18. [Cr(H2O)6]Br3
19. [Ni(NH3)6]Cl2
20. K2[PtCl...
9. [Cu(NH3)4](ClO4)2
10. (NH4)2[SiF6]
11. [Cu(NH3)6]Br2
12. Rb[MnCl3]
13. K2[ReCl6]
14. Na2[Pb(OH)6]
15. K2[ZrF6]
16. [Ni(NH3)6]Br2
17. [Hg(NH3)2]Br2
18. [Cr(H2O)6]Br3
19. [Ni(NH3)6]Cl2
20. K2[PtCl...
 Ag2SO4
Ag2SO4





