Úpravy chemických rovnic – procvičování (kvinta + 1.G)
Transkript
Úpravy chemických rovnic – procvi ování (kvinta + 1.G) A. Neredoxní rovnice v molekulovém tvaru 1. 3 BaCl2 + 2 K3PO4 Ba3(PO4)2 + 6 KCl Al2(SO4)3 + 6 H2O 2. 2 Al(OH)3 + 3 H2SO4 3. Na2B4O7 + H2SO4 + 5 H2O 4 H3BO3 + Na2SO4 SiF4 + 2 H2O 4. SiO2 + 4 HF 5. 2 K2CrO4 + H2SO4 K2Cr2O7 + K2SO4 + H2O 6. As2S3 + 6 HCl 2 AsCl3 + 3 H2S 2 NH3 + K2SO4 + 2 H2O 7. (NH4)2SO4 + 2 KOH 8. 4 H3BO3 + 2 NaOH Na2B4O7 + 7 H2O 9. FeCl3 + 3 NH4OH Fe(OH)3 + 3 NH4Cl 10. PBr3 + 3 H2O H3PO3 + 3 HBr 11. Ca3(PO4)2 + 3 H2SO4 3 CaSO4 + 2 H3PO4 12. PCl5 + H2O POCl3 + 2 HCl 13. Sb2S3 + 6 HCl 2 SbCl3 + 3 H2S B. Neredoxní rovnice v iontovém tvaru 14. 2 Ag+ + CrO42– Ag2CrO4 2– – 2 CrO42– + H2O 15. Cr2O7 + 2 OH 16. ZnO + 2 OH– + H2O [Zn(OH)4]2– 17. 2 Ag+ + 2 OH– Ag2O + H2O 3+ 18. 2 Sb + 3 H2S Sb2S3 + 6 H+ 19. 2 CrO42– + 2 H+ Cr2O72– + H2O 20. Sn4+ + 2 H2S SnS2 + 4 H+ C. Redoxní rovnice v molekulovém tvaru 21. 3 As + 5 HNO3 + 2 H2O 3 H3AsO4 + 5 NO 22. 3 I2 + 10 HNO3 6 HIO3 + 10 NO + 2 H2O 23. 5 H2S + 2 HIO3 5 S + I2 + 6 H2O 24. 6 KI + K2Cr2O7 + 4 H2SO4 3 I2 + Cr2(SO4)3 + 4 K2SO4 + 7 H2O 25. 4 NH3 + 5 O2 4 NO + 6 H2O 26. I2 + 5 Cl2 + 6 H2O 2 HIO3 + 10 HCl 27. AsH3 + 8 HNO3 H3AsO4 + 8 NO2 + 4 H2O 28. Cr2O3 + 3 KNO3 + 2 K2CO3 2 K2CrO4 + 2 CO2 + 3 KNO2 29. 2 BiCl3 + 3 SnCl2 2 Bi + 3 SnCl4 30. 6 HI + H2SO4 (konc.) 3 I2 + S + 4 H2O 31. As2O3 + 2 Br2 + 5 H2O 2 H3AsO4 + 4 HBr 32. 2 KMnO4 + 5 H2O2 + 3 H2SO4 2 MnSO4 + K2SO4 + 5 O2 + 8 H2O 33. 2 KMnO4 + 5 HNO2 + 3 H2SO4 2 MnSO4 + K2SO4 + 5 HNO3 + 3 H2O 34. K2Cr2O7 + 3 H2S + 4 H2SO4 Cr2(SO4)3 + K2SO4 + 3 S + 7 H2O 35. 3 HgS + 2 HNO3 + 6 HCl 3 HgCl2 + 3 S + 2 NO + 4 H2O 36. 6 FeSO4 + 2 HNO3 + 3 H2SO4 3 Fe2(SO4)3 + 2 NO + 4 H2O 37. Cr2(SO4)3 + 3 Cl2 + 16 NaOH 2 Na2CrO4 + 3 Na2SO4 + 6 NaCl + 8 H2O 38. 6 Zn + As2O3 + 6 H2SO4 6 ZnSO4 + 2 AsH3 + 3 H2O 39. 2 KMnO4 + 10 KI + 8 H2SO4 2 MnSO4 + 5 I2 + 6 K2SO4 + 8 H2O 3 Br2 + Cr2(SO4)3 + 4 K2SO4 + 7 H2O 40. 6 KBr + K2Cr2O7 + 7 H2SO4 41. 10 FeSO4 + 2 KMnO4 + 8 H2SO4 5 Fe2(SO4)3 + 2 MnSO4 + K2SO4 + 8 H2O 42. Na2S2O3 + 4 Cl2 + 5 H2O 2 NaHSO4 + 8 HCl -1- D. Reakce disproporciona ní, synproporciona ní a s áste nou oxidací a redukcí v molekulovém tvaru 43. 3 Br2 + 6 KOH 5 KBr + KBrO3 + 3 H2O 44. Cl2 + 2 NaOH NaClO + NaCl + H2O 45. 2 H2S + H2SO3 3 S + 3 H2O 3 Cu(NO3)2 + 2 NO + 4 H2O 46. 3 Cu + 8 HNO3 (z e .) 47. K2Cr2O7 + 14 HCl 2 KCl + 2 CrCl3 + 3 Cl2 + 7 H2O 48. 6 I2 + 6 Ba(OH)2 5 BaI2 + Ba(IO3)2 + 6 H2O NaClO3 + NaClO2 +H2O 49. 2 ClO2 + 2 NaOH 50. 3 KClO3 + 3 H2SO4 HClO4 + 2 ClO2 + 3 KHSO4 + H2O 51. 4 Cd + 10 HNO3 (z e .) 4 Cd(NO3)2 + NH4NO3 + 3 H2O 52. CuS + 10 HNO3 Cu(NO3)2 + H2SO4 + 8 NO2 + 4 H2O 53. 2 P4 + 3 Ba(OH)2 + 6 H2O 2 PH3 + 3 Ba(H2PO2)2 54. 3 Ag + 4 HNO3 (z e .) 3 AgNO3 + NO + 2 H2O 55. 4 KClO3 3 KClO4 + KCl 56. 3 Hg + 8 HNO3 (z e .) 3 Hg(NO3)2 + 2 NO + 4 H2O 57. Cu + 2 H2SO4 (konc.) CuSO4 + SO2 + 2 H2O 58. 2 KMnO4 + 16 HCl 2 KCl + 2 MnCl2 + 5 Cl2 + 8 H2O 59. 4 Zn + 10 HNO3 (z e .) 4 Zn(NO3)2 + NH4NO3 + 3 H2O 60. Fe + 4 HNO3 (z e .) Fe(NO3)3 + NO + 2 H2O 61. 5 KBr + KBrO3 + 3 H2SO4 3 Br2 + 3 K2SO4 + 3 H2O 62. 2 H2S + SO2 3 S + 2 H2O 63. NaIO3 + 5 NaI + 6 HCl 3 I2 + 6 NaCl + 3 H2O E. Redoxní rovnice v iontovém tvaru 64. MnO4– + 5 Fe2+ + 8 H+ Mn2+ + 5 Fe3+ + 4 H2O 65. 6 Br– + Cr2O72– + 14 H+ 3 Br2 + 2 Cr3+ + 7 H2O 66. I– + 2 MnO4– + 3 H2O IO3– + 2 MnO(OH)2 + 2 OH– 67. NO2– + Fe2+ + 2 H+ Fe3+ + NO + H2O 68. 8 I– + SO42– + 10 H+ 4 I2 + H2S + 4 H2O 2– 69. S2O3 + 4 Cl2 + 5 H2O 2 SO42– + 8 Cl– + 10 H+ 70. 8 Al + 3 NO3– + 5 OH– + 18 H2O 8 [Al(OH)4]– + 3 NH3 71. 2 MnO4– + 10 Cl– + 16 H+ 2 Mn2+ + 5 Cl2 + 8 H2O 72. 2 Cr3+ + 3 H2O2 + 10 OH– 2 CrO42– + 8 H2O 73. 2 IO3– + 5 SO32– + 2 H+ I2 + 5 SO42– + H2O 74. 2 Mn2+ + 5 Ag2O2 + 4 H+ 2 MnO4– + 10 Ag+ + 2 H2O 5 Sn4+ + 2 Mn2+ + 8 H2O 75. 5 Sn2+ + 2 MnO4– + 16 H+ 76. 2 Mn2+ + 5 BiO3– + 14 H+ 2 MnO4– + 5 Bi3+ + 7 H2O -2-
Podobné dokumenty
PDF verze
 Disociační konstanty kyselin a zásad
pKa ( pKb ) – záporný dekadický logaritmus disociační konstanty kyseliny (zásady) při 25°C. U vícesytných kyselin (zásad) je stupeň disociace označen římskou čí...
Disociační konstanty kyselin a zásad
pKa ( pKb ) – záporný dekadický logaritmus disociační konstanty kyseliny (zásady) při 25°C. U vícesytných kyselin (zásad) je stupeň disociace označen římskou čí...
Redox rovnice
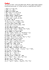 Je možné, že sem – tam se vloudila chyba. Prosím o jejich najití a splnění
oznamovací povinnosti :-)!!! S díky na rtech a s vděčností srdci Váš K.V.
1. HgS + O2 –> Hg + SO2
2. BaO + O2 –> BaO2
3. P...
Je možné, že sem – tam se vloudila chyba. Prosím o jejich najití a splnění
oznamovací povinnosti :-)!!! S díky na rtech a s vděčností srdci Váš K.V.
1. HgS + O2 –> Hg + SO2
2. BaO + O2 –> BaO2
3. P...
Write the following stoichiometric chemical equations in ionic form
 Na2CO3(s) + 2 HCl(aq) ⎯→ CO2(g) + 2 NaCl(aq) + H2O(l)
H2SO4(aq) + 2 KOH(aq) ⎯→ K2SO4(aq) + 2 H2O(l)
Ba(OH)2(aq) + 2 CH3COOH(aq) ⎯→ Ba(CH3COO)2(aq) + H2O(l)
Zn(s) + 2 HCl (aq) ⎯→ ZnCl2(aq) + H2(g)
N...
Na2CO3(s) + 2 HCl(aq) ⎯→ CO2(g) + 2 NaCl(aq) + H2O(l)
H2SO4(aq) + 2 KOH(aq) ⎯→ K2SO4(aq) + 2 H2O(l)
Ba(OH)2(aq) + 2 CH3COOH(aq) ⎯→ Ba(CH3COO)2(aq) + H2O(l)
Zn(s) + 2 HCl (aq) ⎯→ ZnCl2(aq) + H2(g)
N...
vypocty_chemie_101222 | 262.8 KB
 5. Měděná ruda obsahuje Cu2S a Cu2Ov hmotnostním poměru 1:1. Kolik tun této rudy bude
potřeba na výrobu 3,8 tun mědi, neuvažujeme-li ztráty?
6. Kolik gramů železa je zapotřebí k vytěsnění 5 g mědi ...
5. Měděná ruda obsahuje Cu2S a Cu2Ov hmotnostním poměru 1:1. Kolik tun této rudy bude
potřeba na výrobu 3,8 tun mědi, neuvažujeme-li ztráty?
6. Kolik gramů železa je zapotřebí k vytěsnění 5 g mědi ...
 Selektivní reakce:
b) Alkalické chromany
Na2CrO4 , K2CrO4
Selektivní reakce:
b) Alkalické chromany
Na2CrO4 , K2CrO4
 kovů. Jedná se o standardní potenciály dílčí redoxní reakce
kovů. Jedná se o standardní potenciály dílčí redoxní reakce
 TG – chemie – kvinta
TG – chemie – kvinta

 ROZetA k RADiÁtORŮM
15/22mm | komerce
ROZetA k RADiÁtORŮM
15/22mm | komerce
 Terciární alkoholy se dehydratují E1 mechanismem.
Terciární alkoholy se dehydratují E1 mechanismem.



