Termodynamika
Transkript
Termodynamika Martin Keppert Katedra materiálového inženýrství a chemie [email protected] http://tpm.fsv.cvut.cz/ Co to je termodynamika Nauka o energii, jejích formách a přenosu Energie schopnost systému konat práci nebo vyměňovat teplo s okolím (teplo a práce – formy přenosu energie mezi systémem a okolím) nebo - schopnost měnit současný stav – systému i jeho okolí Zákon zachování energie: energii nelze vyrobit ani zničit, pouze přeměňovat na jinou formu energie Postulát o existenci termodynamické rovnováhy každý systém se při konstantních vnějších podmínkách snaží dostat do rovnováhy (a povede se mu to) – všude je stejná teplota, tlak, koncentrace složek, nemění se chemické složení, fáze jsou v rovnováze Termodynamický systém Systém: část světa, která nás zajímá Zbytek světa = okolí Izolovaný systém: nevyměňuje s okolím ani hmotu, ani energii nápoj v zavřené termosce Uzavřený systém: vyměňuje s okolím energii, ne hmotu zavřená láhev s nápojem Otevřený systém: vyměňuje s okolím energii i hmotu otevřená láhev s nápojem Druhy energie podle působící síly Mechanická energie tělesa: kinetická potenciální Vnitřní energie systému: tepelná (vibrace a rotace molekul) chemická energie vazby mezi atomy jaderná energie sil mezi elementárními částicemi Elektrická způsobena rozdíly elektrických potenciálů Energie záření Vnitřní energie Jakou má nápoj energii?? Izolovaný systém (nápoj v termosce): Mimo silová pole Nehýbe se 1. Pohybová energie všech molekul 2. Energie vazeb mezi atomy („chemická“) 3. Energie elementárních částic (jádra, elektrony) 4. Potenciálové pole molekul – molekulární síly (kohezní síly) mezi molekulami Vnitřní energie U Nevyčíslitelná Jednotky energie (práce, tepla) Joule J odvozená jednotka SI 1 J je práce, kterou koná síla 1 N po dráze 1 m V základních jednotkách: kg m2 s-2 Kalorie cal 1 cal = 4,187 J (z tepelné Elektronvolt eV 1 eV = 1,602 x 10-19 J kapacity vody, 8 typů cal) BTU: British Thermal Unit TOE: Ton of Oil Equivalent tTNT: Ton of TNT 1 BTU = 1055 J 1 TOE = 42 GJ 1 tTNT = 4,187 GJ = 1 Gcal Energie a výkon Výkon = práce(teplo)/čas W J s1 Watt P t Odvozená jednotka pro práci (energii): wattsekunda kilowatthodina 1 kWh = 3,6 MJ Koňská síla (HP, k, ks) Koňská síla: 1 k (HP) = 746 (735) W UK, USA Joulův experiment Vzrůst teploty = vzrůst vnitřní energie Síla působící po dráze = mechanická práce James Joule, 1845, „On the mechanical equivalent of heat“ Read before the British Association at Cambridge, June 1845 První věta termodynamická matematické vyjádření zákona zachování energie pro uzavřený systém (v klidu, mimo silová pole) U U2 U1 Q W Teplo + Práce Formy přenosu energie mezi systémem a okolím +energie systému roste (příjem Q a W) - energie systému klesá (systém koná práci, odevzdává teplo) cyklický děj (systém se vrací do výchozího stavu) ΔU=0 → nelze sestrojit stroj cyklicky produkující práci (nebo převádějící teplo na větší množství práce) - perpetuum mobile I. druhu Práce Přenos energie „uspořádaným pohybem“: mechanická práce: působení síly po dráze (F.s) objemová práce tlak vnější!! válec s pístem V2 V2 V2=V1+ΔV V1 W pext dV V1 ohřev objem roste, tlak klesá systém koná práci Elektrická práce: uspořádaný pohyb elektronů vodičem Molární tepelná kapacita cp (izobarická) Tepelná kapacita za konstantního tlaku 1 Q J K 1mol1 c p limT2T1 n T2 T1 Teplo potřebné k ohřátí jednoho molu látky o infinitezimální rozdíl teploty Vlastnost čisté látky, závisí na skupenství a teplotě. Voda led (-10 °C) Kapalná voda (25 °C) Vodní pára (100 °C) 2.05 J/(g.K) 4.18 J/(g.K) 2.08 J/(g.K) cp a bT cT2 dT 1 eT 2 J.g1.K 1 Tabulky, databáze, rozsah teplot pro použití Molární tepelná kapacita cv (izochorická) Tepelná kapacita za konstantního objemu (používá se pro plyny) 1 Q J K 1mol1 c V limT2T1 n T2 T1 Orientační výpočty tepla a teploty při ohřevu/chlazení Q c T cp i cV , pro pevné látky obvykle cp Ohřejeme jeden mol argonu z 20 °C teplem 500 J. Jaká bude teplota v nádobách? cp = 20,8 J K-1 mol-1 cV = 12,5 J K-1 mol-1 [P] [V] 1 mol Ar 1 mol Ar ETA Entalpie H – míra celkové energie systému systém koná pouze objemovou práci (ne elektrickou, povrchovou atd.): ohřev vody v hrnci, při zahřívání se zvětšuje objem = systém koná objemovou práci V2 Q U p dV U pV V1 U Q W Při [p] Např. v atmosféře Definice entalpie H H U pV H U pV H Q p Izochorický děj [V]: Q U Výpočet změny entalpie Použití entalpie k výpočtu tepla: plynné systémy za [p], kapalné a pevné systémy vždy – zanedbatelná objemová práce (za běžných podmínek) Porovnáním definice ΔH a cp zjistíme, že dHm cp dT p Výpočet změny entalpie (tepla) systému při změně teploty: Rozšíření výpočtu na celý systém cp je funkce teploty T2 Qp H n c p T dT T1 Kolik kg hnědého uhlí (výhřevnost 13 MJ/kg) je potřeba pro ohřev vody při zabíjačce jednoho prasete? Uvažujte ohřev 200 litrů vody z 10 na 90 ˚C. Účinnost kotle je 40 %. Molární tepelná kapacita vody je dána: cpm=66,54+0,028*T [J K-1 mol-1] T2 Qp H n c p T dT T1 Měření tepelné kapacity Adiabatický elektrický kalorimetr adiabatický – nevyměňuje teplo s okolím – dokonale izolovaná nádoba Elektrický kalorimetr pro měření cp kapalin studovaná kapalina „Vodní hodnota“, „kalorimetrická konstanta“ = tepelná kapacita kalorimetru - experiment Do elektrického kalorimetru bylo předloženo 200 g CCl4 (tertrachlormethan, 1,3 molu). Kalorimetr byl vytemperován v laboratoři na 22 °C a byl zapnut elektrický ohřev. Topnou spirálou o odporu 80 Ω procházel proud 1.2 A po dobu 30 s. Teplota CCl4 vzrostla o 2.2 °C. Určete molární tepelnou kapacitu CCl4. Tepelná kapacita prázdného kalorimetru byla 1400 JK-1. Adiabatický směšovací kalorimetr: dobře izolovaná nádoba (Q=0) Do kapaliny o známé teplotě t1 a tepelné kapacitě cl je vložen pevný vzorek studované látky o teplotě t2. Pak se měří se vývoj teploty kapaliny v čase – po ustálení (t) se vypočte tepelná kapacita pevné látky cs. studovaná látka Joulův – Thomsonův jev Izoentalpická expanze plynu (p1 > p2) p1, T1 p2, T2 Porézní přepážka, tryska… Joule-Thomsonův koeficient JT T p H int T2 T1 p2 p1 μJT kladný: plyn se při expanzi ochlazuje – drtivá většina plynů μJT záporný: plyn se při expanzi ohřívá – H2, He, Ne μJT – vlastnost plynu, závisí na teplotě a tlaku inverzní teplota: změna znaménka μJT Inverzní teploty He H2 Ne N2 O2 40 K 202 K 231 K 621 K 764 K Integrální Joule-Thomsonův koeficient pro vodík při standardním tlaku a teplotě je -0.06 K/bar. O kolik stupňů se ohřeje vodík při expanzi z plné tlakové lahve (přetlak 20 MPa) do atmosféry? int T2 T1 p2 p1 Tepelné stroje Převod práce na teplo – snadný (tření, disipace) Převod tepla na práci (parní stroj, spalovací turbína, parní turbína, spalovací motor) práce – uspořádaný pohyb částic x teplo – chaotický pohyb Obrácený tepelný stroj přenos tepla z místa o nižší teplotě na místo o vyšší teplotě Entropie = míra (ne)uspořádanosti systému (větší chaos=větší entropie) Uspořádané stavy jsou méně pravděpodobné, než neuspořádané – entropie roste samovolné děje: jejich entropie roste, můžou konat práci 1. 2. aby klesala, musíme dodat práci (uspořádat částice) 2. věta – postulát entropie Clausiův theorém: není možné sestavit takový cyklický stroj, který by jen převáděl teplo z chladnějšího zásobníku na teplejší (nebo teplo ze 100% na práci – Thomsonův theorém) tropeion = udávat směr (toku času) vratný děj nevratný děj dQ S T dQ S T teplo přichází – S roste teplo odchází S klesá izolovaný systém: S 0 S0 Entropie v izolovaném systému nemůže klesat. při nevratných dějích entropie roste – celý vesmír Perpetuum mobile I. Druh – odporuje první větě – zákonu zachování energie II. Druh – tepelný stroj převádějící teplo pouze na práci (odporující druhé větě) Reálný tepelný stroj: benzínový (Ottův, zážehový) motor Vznětový motor (diesel) Krok stranou - turbína Přeměna energie proudícího Media na rotační pohyb Parní Spalovací – letadla Parní cyklus (Rankin-Calusius) http://home.zcu.cz/~gaspar/Termomechanika.htm Uhelná (jaderná) elektrárna Kotel – ohřev, výpar Přehřátá pára Kondenzátor - chladič Atmosférický parní stroj Atmosferický = návrat pístu do dolní úvratě díky atmosferickému tlaku Kondenzace páry pomocí vstříknutí studené vody Cyklický proces Thomas Newcomen 1712 1765: dvojčinný parní stroj (James Watt) Horká natlakovaná pára z kotle Výfuk ochlazené páry tlak páry Indikátorový diagram parního stroje: P pozice pístu V Sadi Carnot 1796-1832 Carnotův cyklus adiabaty: Q=0 izotermy Carnotův tepelný stroj převádí vratně teplo z teplejšího zásobníku (parní kotel) do chladnějšího (atmosféra) a koná práci – plocha uvnitř pV cyklu S Q2=Q1+W dQ T Maximální účinnost VŠCHT: Carnotův cyklus. [online]. [cit. 2008-07-08]. http://www.vscht.cz/fch/prikladnik/zkhtml/p.1.2.24.html#avpr vykonaná práce W T2 T1 Q2 T2 přijaté teplo Pára v kotli lokomotivy má teplotu 300 ˚C, expanze probíhá do atmosféry (293 K). Jaká je maximální účinnost tohoto parního stroje? vykonaná práce W T2 T1 Q2 T2 přijaté teplo Tepelné čerpadlo a lednička – „obrácený tepelný stroj“ Přenos tepla z chladnějšího místa na teplejší pomocí práce Teplejší zásobník: byt, prostor za ledničkou 2. Zvýšení tlaku → kondenzace → uvolnění tepla chladnější+práce=teplejší Chladnější zásobník – řeka, země, vnitřek ledničky 1. Snížení tlaku → var (výpar) → přijímání tepla z chladnějšího zásobníku
Podobné dokumenty
Kyseliny
 • Uvolňuje se velké množství tepla – může dojít k
vystříknutí roztoku třeba do obličeje.
• Při ředění kyseliny sírové nutno ještě směs
chladit.
• Uvolňuje se velké množství tepla – může dojít k
vystříknutí roztoku třeba do obličeje.
• Při ředění kyseliny sírové nutno ještě směs
chladit.
Modem MRS32
 napájení modemu 0V
napájení modemu +12V
vstup pro 4-drát
vstup pro 4-drát
vstup/výstup 2-drát, výstup pro 4-drát
vstup/výstup 2-drát, výstup pro 4-drát
napájení modemu 0V
napájení modemu +12V
vstup pro 4-drát
vstup pro 4-drát
vstup/výstup 2-drát, výstup pro 4-drát
vstup/výstup 2-drát, výstup pro 4-drát
Bendamustine plus rituximab versus CHOP plus rituximab as first
 RCHOP je považován za standardní způsob léčby pokročilých indolentních lymfomů a
starších pacientů s mantle-cell lymfomem. Bendamustin s rituximabem je účinný v léčbě
relapsu nebo u refrakterních p...
RCHOP je považován za standardní způsob léčby pokročilých indolentních lymfomů a
starších pacientů s mantle-cell lymfomem. Bendamustin s rituximabem je účinný v léčbě
relapsu nebo u refrakterních p...
Měření kmitočtu a tvaru signálů pomocí osciloskopu
 obrazovce 8 cm naměřit maximální napětí 8 cm • 20 V/cm = 160 V. Při vyšších napětích než 160 V je
nutné na osciloskop připojit poměrovou sondu, která funguje jako dělič napětí. Sonda na obr. 4 dělí...
obrazovce 8 cm naměřit maximální napětí 8 cm • 20 V/cm = 160 V. Při vyšších napětích než 160 V je
nutné na osciloskop připojit poměrovou sondu, která funguje jako dělič napětí. Sonda na obr. 4 dělí...
07 CZ Stredotlak. axi.lne vent str.indd - COM
 z oceli se speciální povrchovou úpravou nebo z nerezu pro nestandardní složení dopravovaného vzduchu). Lopatky
s aerodynamickým profilem zaručují vysokou účinnost a nízkou hlučnost. Konstrukce nábo...
z oceli se speciální povrchovou úpravou nebo z nerezu pro nestandardní složení dopravovaného vzduchu). Lopatky
s aerodynamickým profilem zaručují vysokou účinnost a nízkou hlučnost. Konstrukce nábo...
2. věta termodynamiky
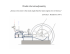 Není možné sestrojit zařízení, které by nekonalo nic jiného, než převádělo teplo z
chladnějšího tělesa na teplejší. (Teplo nemůže samovolně proudit z chladnějšího
tělesa na teplejší.)
Kelvinova for...
Není možné sestrojit zařízení, které by nekonalo nic jiného, než převádělo teplo z
chladnějšího tělesa na teplejší. (Teplo nemůže samovolně proudit z chladnějšího
tělesa na teplejší.)
Kelvinova for...
 viskozita …
viskozita …